Autor : Carlos M. Luna1, Laura Pulido2, Oscar Rizzo3, MarĂa Laura Gauna4, Alejandro Chirino5, Alejandro J. Videla6
1 Departamento de Medicina, DivisiĂłn NeumonologĂa, Hospital de ClĂnicas, Facultad de Medicina, Universidad de Buenos Aires, Buenos Aires, Argentina. 2 Hospital Italiano de Rosario, Sanatorio Americano. Rosario, Santa Fe. Argentina. 3Hospital MarĂa Ferrer. Universidad de Buenos Aires. Argentina. 4Hospital Alberto Conacchiari Leandro N. Alem, Buenos Aires. Sanatorio JunĂn, JunĂn, Buenos Aires. 5Respira Salud. ClĂnica Integral, Mendoza, Argentina. 6Hospital Universitario Austral. Universidad Austral. Pilar, Argentina.
https://doi.org/10.56538/ramr.QIDV5309
Correspondencia : Carlos M. Luna: Autor corresÂponsal: Carlos M. Luna, DirecÂciĂłn Postal: Arenales 2557, Piso 1, Dto A. CĂłdigo Postal: 1425, Ciudad AutĂłnoma de Buenos Aires, Argentina. E-mail: dr.cm.luna@gmail.com
RESUMEN
Los
adultos fumadores, con comorbilidades, y los ancianos tienen mayor riesgo de
contraer infecciones pulmonares y de tener peor evoluciĂłn. La neumonĂa
adquirida en la comunidad debida a virus, neumococo, además de otras bacterias
y microorgaÂnismos “atĂpicos” afecta tanto a adultos sanos como enfermos. La
vacuna antigripal se diseña el verano anterior orientada
a las cepas esperadas para la temporada siguiente. Su eficacia depende
fundamentalmente de la variante viral que finalmente sea la responsable del
brote. La vacuna anti-neumocócica polisacárida
existe desde 1983 y será inexorablemente reemplazada por vacunas conjugadas de
mayor eficacia, que previenen la infecciĂłn por los serotipos presentes en la
vacuna. La inmunizaciĂłn contra SARS-CoV-2 acelerĂł la reducciĂłn del contagio y
la gravedad de COVID-19 notablemente. La vacuna acelular
para Bordetella pertussis
no está en el calendario de adultos, aun cuando vacunarlos fortalece el
control del contagio infantil. La vacunas doble bacteriana (difteria y tétanos),
y triple (doble + pertusis), y contra sarampiĂłn,
varicela, rubeola, HPV, Haemophylus influenzae, meningococo, herpes zĂłster, fiebre
hemorrágica argentina y fiebre amarilla están disponibles, pero son de uso
limitado. Nuevas vacunas, como la recientemente aprobada por los CDC contra el
virus sincicial respiratorio, pronto estarán
disponibles.
Palabras
clave: InmunizaciĂłn,
Influenza, Neumococo, Difteria, TĂ©tanos, Herpes zĂłster, COVID-19, Virus sincicial respiratorio, Vacunas
ABSTRACT
Adult smokers, subjects with
comorbidities, and the elderly are at higher risk of pulmoÂnary infections and
worse outcomes. Community-acquired pneumonia due to viruses, pneumococcus, other
bacteria, and “atypical” microorganisms affects healthy and sick adults. The
flu vaccine is designed the previous summer for the strains expected for the
following season. Its effectiveness depends fundamentally on the viral variant
ultimately responsible for the outbreak. The anti-pneumococcal polysaccharide
vaccine has been available since 1983 and it is expected to be replaced by
conjugate vaccines which are more effective in preventing infection due to
serotypes present in the vaccine. ImmunizaÂtion against SARS-CoV-2 diminished
contagion and severity of COVID-19 remarkably. The acellular
vaccine for Bordetella pertussis is not
on the schedule for all adults, even when vaccinating them strengthens the
control of contagion in children. Double bacterial (diphtheria and tetanus),
triple (double + pertussis), measles, varicella, rubella, HPV, Haemophilus influenzae,
meningococcal, herpes zoster, Argentine hemorrhagic fever, and yellow fever
vaccines are available, but their use is limited. New vaccines such as the one
recently approved by the CDC against respiratory syncytial virus will soon be
available.
Key word: Immunization, Influenza, Pneumococcus, Diphtheria, Tetanus, Herpes
zoster, COVID-19, Respiratory syncytial virus, Vaccines
Recibido: 10/07/2022
Aceptado: 25/08/2023
INTRODUCCIĂ“N
El
especialista en enfermedades pulmonares desÂtina parte de su tiempo en la
consulta a revisar la historia vacunal de sus
pacientes. En 2015, la AsociaciĂłn Argentina de Medicina Respiratoria (AAMR) encarĂł
la iniciativa institucional de elaÂborar recomendaciones de vacunaciĂłn en
adultos con enfermedades respiratorias.1
En los Ăşltimos decenios, creciĂł la expectativa de vida y la edad
poblacional, con lo que se incrementĂł el porcentaje de pacientes con comorbilidades
y de mayores de 65 años (habitualmente candidatos a vacunarse). Este grupo
representaba entre el 10% y el 19% de la poblaciĂłn en 2015, y se espera que sea
entre el 25% y el 29% en 2050.2 En los ocho
años transcurridos desde la publicación de nuestra recomendación, emergió la
pandemia de COVID-19, que trajo imÂportantes avances en la elaboraciĂłn de
vacunas e impactĂł de manera notable en la conciencia de la necesidad de esta
práctica preventiva y la percepÂciĂłn de su impacto en la prevenciĂłn de
enfermedad y sus consecuencias de morbimortalidad.3
La
apariciĂłn de SARS-CoV-2 como patĂłgeno principal de las infecciones
respiratorias durante los últimos tres años ha mostrado las debilidades y
fortalezas de los programas de vacunaciĂłn, lo que, junto con las nuevas vacunas
que han sido aproÂbadas en el mundo durante los Ăşltimos años, nos obliga a
revisar de la mejor manera posible nuestro punto de vista y a actualizar las
recomendaciones sobre vacunaciĂłn contra la influenza (VAG), neuÂmococo (VAN),
COVID-19 (VAC), Bordetella perÂtussis (VBP), herpes zĂłster (VHZ) y virus sincicial respiratorio (VSR).4
El
Ministerio de Salud de la NaciĂłn (MSAL), en Argentina, de manera similar a lo
que hacen los organismos oficiales de salud pĂşblica de otros paĂses, como los Centers
for Disease Control and Prevention (CDC) de Estados Unidos o el EuroÂpean Centre for Disease Prevention and Control (ECDC)
en Europa generan recomendaciones de vacunaciĂłn desde el nacimiento y a lo
largo de toda la vida.5
ANTECEDENTES
El
MSAL ha definido un calendario nacional compuesto por 17 vacunas indicadas en
los niños a partir del nacimiento con expresa indicación del número de dosis,
momento en que deben aplicarÂse, refuerzos y descripciĂłn de algunos esquemas
especiales.5 También ha precisado
distintas indiÂcaciones de vacunas en algunos grupos poblacioÂnales de riesgo,
como embarazadas, puérperas y personal de salud. Curiosamente en el calendario
para otros menores de 65 años y sin comorbilidades se mencionan solo la vacuna
para hepatitis B y la doble bacteriana. Para embarazadas, puérperas y personal
de salud, se indican las mismas vacunas y se agregan las dosis necesarias de
triple bacteriana y triple viral. En mayores de 65 años o menores de esa edad,
con comorbilidades, enfermedades respiratorias y fumadores con riesgo aumentado
de padecer infecciones pulmonares virales y bacteÂrianas y sus consecuencias,
se incluyen las vacunas antigripales y antineumocĂłcicas,
además de las mencionadas.5 Existen
esquemas de vacunación para SARS-CoV-2 que están sujetos a cambios según la
evoluciĂłn de la pandemia, difĂciles de predecir.
La
neumonĂa adquirida en la comunidad (NAC) se presenta en más del 1% de las
personas cada año.6 Los posibles
patĂłgenos de la NAC incluyen virus, bacterias comunes, bacterias intracelulares
o atĂpicas, hongos y protozoarios.7 Las
infecciones por algunos de estos patógenos pueden prevenirse a través de la
inmunizaciĂłn por medio de vacunas. Por ello, los CDC de Estados Unidos
recomiendan la vacunaciĂłn durante toda la vida para proporÂcionar inmunidad.
Sin embargo, las tasas de vaÂcunaciĂłn en adultos en todo el mundo son bajas.8
A
principios del siglo XX la causa principal de muerte en el mundo eran las
infecciones pulmoÂnares agudas (caracterizadas como influenza y neumonĂa). Los
avances de la medicina mejoraron notablemente la expectativa de vida hasta
cerca de los 80 años y, aunque las infecciones pulmonares quedaron relegadas
como causa de muerte tras las enfermedades cardiovasculares, los tumores
malignos, las lesiones no-intencionales y las enÂfermedades respiratorias
crĂłnicas, durante 2020 y 2021 la COVID-19 se convirtiĂł en la primera causa de
letalidad en muchos paĂses, lo que volviĂł a poner a las infecciones en primer
plano.9
VACUNACIĂ“N ANTIGRIPAL
La
influenza se caracteriza por epidemias anuales que se presentan en todo el
mundo en temporada invernal (entre abril y octubre en el hemisferio sur y entre
octubre y abril en el hemisferio norte). Estas epidemias pueden tener un grado
variaÂble de gravedad. La gripe se caracteriza por un cuadro de comienzo agudo,
con fiebre o sin esta, con sĂntomas generales y respiratorios, que suele
mejorar en alrededor de 7 d a 10 d. En algunos casos, particularmente en
mayores de 65 años, y en adultos y niños con afecciones crónicas de los
aparatos respiratorio y cardiovascular, enfermeÂdades metabĂłlicas,
insuficiencia renal, hemogloÂbinopatĂas e inmunosupresiĂłn (incluido VIH +),
puede requerirse atención médica, internaciones o, incluso, producirse un
desenlace fatal.10 Por ello, el Calendario Nacional de VacunaciĂłn
del MinisÂterio de Salud de Argentina recomienda la vacuna para influenza a
partir de los 6 meses de edad sin lĂmite máximo de edad en las personas con
mayor riesgo de complicaciones en caso de gripe. También se recomienda la
vacunaciĂłn del personal de salud, los convivientes de pacientes
inmunodeprimidos y las personas que trabajan en contacto con aves vivas.10 En el manual
del vacunador del MSAL 2014 ya se indicaba: “En los pacientes mayores de 65
años, no se requerirá orden médica para recibir la vacuna antigripal”, en un
intento de reducir los obstáculos para lograr buenos niveles de vacunación.
Cabe recordar la importancia de la revacunaciĂłn anual a raĂz de la caĂda en los
tĂtulos de anticuerpos y la pĂ©rdida de eficacia vacunal
a partir de los cambios radicales antigĂ©nicos en los componentes de hemaglutinina (H) o neuraminidaÂsa
(N) (shift antigénico) o de cambios
menores en la estructura de estas proteĂnas (drift
antigénico) que experimenta periódicamente el virus.11, 12
Los
CDC en Estados Unidos en 2010 (luego de la pandemia de H1N1) simplificaron la
recomenÂdaciĂłn: “Todas las personas mayores de 6 meses en los Estados Unidos
deben vacunarse contra la influenza cada temporada, con raras excepcioÂnes”,13 y aclararon
que, si la provisiĂłn de vacuna fuera limitada, se debe priorizar a los de edad
mayor de 65 años, comorbilidades y contactos de personas con riesgo aumentado.
Esta limitaciĂłn de cobertura para casos de escasez se asemeja a la
recomendaciĂłn habitual en Argentina.
De
los cuatro tipos de virus influenza reconociÂdos, solo los virus tipos A y B
causan epidemias en la actualidad en humanos. El tipo A se divide en distintos
subtipos basados en sus proteĂnas de suÂperficie H y N. Los dos subtipos de virus
Influenza A que circulan en el momento de redacciĂłn de este documento son A(H1N1) y A(H3N2). Los virus de Influenza B se clasifican en
los dos linajes actualÂmente circulantes: B/Victoria y B/Yamagata. La apariciĂłn
de errores en la polimerasa dependiente de ARN en coinfecciones
entre humanos y otras especies modifica los virus, lo que favorece la cirÂculaciĂłn
de esta variante en un nuevo huésped.14
Desde
fines de la década del setenta se dispone de la vacuna trivalente (dos subtipos
de virus A y un linaje de virus B). En Argentina está disponible la vacuna
trivalente inactivada orientada a las cepas patrĂłn recomendadas por la OMS para
el perĂodo en cuestiĂłn.10 Asimismo,
desde hace unos años está tambiĂ©n disponible la vacuna tetravaÂlente con dos
subtipos del virus A y los dos linajes del B. También se dispone de la vacuna
trivalente inactivada con adyuvante que mejora el efecto de inmunizaciĂłn. Un
adyuvante es un ingrediente que ayuda a crear una respuesta inmunitaria más
fuerte, lo que mejora su efectividad particularmenÂte en mayores de 65 años y
en personas menores de 65 años con comorbilidades y en individuos
inmunocomprometidos.15 Finalmente,
tambiĂ©n se dispondrá en Argentina de la vacuna contra inÂfluenza de alta dosis,
recientemente aprobada por ANMAT. Mientras que la mayorĂa de las vacunas
contienen 15 μg de cada antĂgeno de H, la vacuna
de alta dosis presenta 60 μg de cada antĂgeno.16 En agosto del
2022, se realizĂł un estudio de viabiliÂdad en Dinamarca, que mostrĂł una
reducciĂłn del 49% en el riesgo de muerte asociado a la vacuna de alta dosis y
también una reducción del 64% en la incidencia de hospitalización por influenza
o neumonĂa en comparaciĂłn con la vacunaciĂłn de dosis estándar en adultos
mayores.17 Además, es
importante destacar que la mayorĂa de las vaÂcunas inactivadas contra la
influenza se fabrican utilizando el método de cultivo de los virus de la
influenza en huevos embrionados. Sin embargo, también
existen vacunas elaboradas a partir de lĂÂneas celulares, que ofrecen ventajas
significativas, como la capacidad de producir mayores cantidades de vacunas de
manera más rápida. Las vacunas derivadas de lĂneas celulares tienen el
beneficio adicional de evitar la posibilidad de mutaciones que puedan surgir
durante el cultivo en huevos embrionados y no
requerir el uso de proteĂnas de huevo, lo que puede ser beneficioso para
ciertas personas con alergias o restricciones dietéticas.18
Existen vacunas a virus vivos atenuados (de apliÂcaciĂłn intranasal) y recombinante, que hasta el momento no están disponibles
en nuestro paĂs.10
En
el año 2013, se dispuso de la primera vacuna tetravalente (dos subtipos de
virus A y dos linajes de virus B),12 con un
buen perfil de seguridad. Agregar un segundo linaje B a la vacuna antigriÂpal
proporciona una respuesta inmune superior para el subtipo adicional, sin
reducir la respuesta inmunitaria para los otros tres subtipos ni afectar
negativamente el perfil de tolerancia y seguridad. Al ofrecer una protecciĂłn
más amplia contra los diferentes linajes de virus de influenza B que co-circulan, la vacuna tetravalente tiene el potencial de
reducir aún más la morbilidad y mortalidad relacionadas con la influenza más
allá de lo logrado con las vacunas trivalentes.19, 20 En la actualidad, en Estados Unidos, y en
varios paĂses de Europa la vacuna tetravalente ha reemplazado a la vacuna
trivalente.13,
15
El
conjunto de pacientes que se atienden con el neumonĂłlogo
se caracteriza en general por tener un alto riesgo de sufrir complicaciones a
partir de influenza grave.21 La vacuna
antigripal en adultos se recomienda en mayores de 65 años y menores de 65 años
con enfermedad pulmonar crónica o cardiovascular, renal, hepática, neurológica,
trastornos metabĂłlicos –que incluyen diabetes, hemoglobinopatĂas e
inmunosupresiĂłn (incluido VIH +)–, lo cual abarca una amplia mayorĂa de los
pacientes que se atienden con un neumonĂłlogo.
Por
otra parte, la estacionalidad de la influenza plantea un desafĂo para
determinar el momento óptimo de vacunación en América Latina. Mientras en
climas templados, como América del Sur, hay picos de actividad durante los
meses de invierno; en regiones tropicales y subtropicales, la influenza se
manifiesta a lo largo del año, especialmente en temporada de lluvias.22 Hive y cols. realizaron un análisis sobre la base de
estudios de estacionalidad de influenza producido por la CDC y la OMS, entre
otros, que recopilan datos de 138 paĂses ubicados total o parcialmente entre el
paralelo 38 norte y sur, y concluyeron que la temporada principal de influenza
en la mayorĂa de paĂses de AmĂ©rica del Sur es entre abril y junio.23
La
eficacia y los efectos colaterales de la vacuna antigripal se midieron como
para cualquier otro fármaco con ensayos clĂnicos aleatorizados, doble-ciego. La
eficacia en la vida real de vacunas ya autorizadas en uso se hace a través de
estudios de efectividad. La efectividad de las vacunas se relaÂciona con la
edad, la presencia de comorbilidades y también cobertura en la vida real de las
cepas del virus circulante.
La
efectividad de la vacuna es calculada todos los años por la CDC.24 En la Figura
1, puede observarse la efectividad de la VAG medida durante dieciséis 8
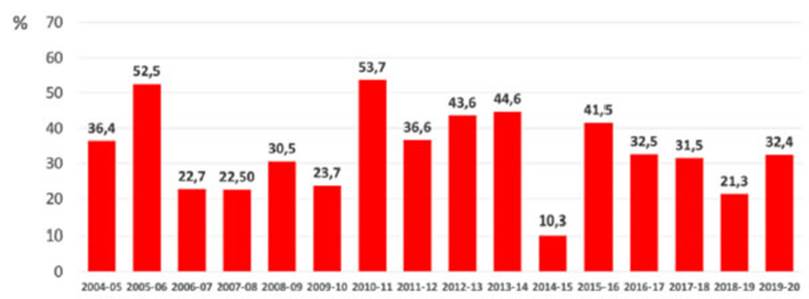
De las Ăşltimas diecisiete temporadas de
influenza en el hemisferio norte (no se midiĂł en la tempoÂrada 2020-2021 por la
baja circulaciĂłn viral que se produjo en la temporada debido al aislamiento
riguroso que existiĂł durante la pandemia).
Si
bien a primera vista llama la atenciĂłn la efecÂtividad modesta de las vacunas
contra la influenza actualmente disponibles, como se ha apreciado recientemente
con la pandemia de SARS-CoV-2, la vacuna puede prevenir complicaciones graves
de influenza, como la internaciĂłn en UCI (reducÂciĂłn del 26%) y la mortalidad
(reducciĂłn del 31%) entre adultos con influenza asociada a ingreso
hospitalario.25,
26
VACUNACIĂ“N
ANTINEUMOCĂ“CICA
Antes
de 1945, la neumonĂa en adultos era causaÂda en más del 90% de los casos por Streptococcus pneumoniae.
Sin embargo, a partir de 1950, la proporciĂłn de neumonĂas causadas por este orgaÂnismo
comenzĂł a disminuir. En la actualidad, la presencia de neumococos se encuentra
en menos del 10%-15% de los casos; esta proporción es más alta en Europa y se
estima que se debe a diferencias en las prácticas de vacunación y el hábito de
fumar. Otros patĂłgenos, como bacilos gramnegativos, Staphylococcus
aureus, Chlamydia, Mycoplasma
y Legionella son identificados en
un rango del 2% al 5% de los pacientes hospitalizados por neumonĂa. Los virus
se encuentran en el 25% de los pacientes y, aproximadamente, un tercio de ellos
presentan coinfecciĂłn bacteriana. Es importante
destacar que, en más del 50% de los casos, los estudios recientes no han
logrado identificar el organismo causante, lo cual sigue siendo el principal
desafĂo para comprender las infecciones respiratorias bajas.27
El
calendario de vacunaciĂłn 2023 en Argentina no precisa las indicaciones sobre la
vacuna antiÂneumocĂłcica (VAN) solo recomienda en el
adulto el uso del esquema secuencial. En el documento Lineamientos TĂ©cnicos
y Manual del Vacunador de la VacunaciĂłn contra Neumococo, Estrategia TĂ©cnica
2017-2018, el MSAL indica que debe aplicarse la vacuna VAN en adultos que
integran grupos de alto riesgo de padecer enfermedades invasivas, que incluyen
anemia drepanocĂtica, cardiopatĂa congĂ©nita,
enfermedades pulmonares crĂłnicas, diabetes mellitus, hepatopatĂa
crĂłnica, fĂstula de lĂquido cefalorraquĂdeo, asplenia
funcioÂnal o anatĂłmica, implante coclear, infecciĂłn por VIH, leucemias,
linfomas Hodgkin y no-Hodgkin,
mieloma mĂşltiple, otras neoplasias, falla renal crĂłnica, sĂndrome nefrĂłtico,
tratamientos con quimioterapia o corticoides, trasplantes de ĂłrgaÂnos. En otro
punto respecto de la revacunaciĂłn afirma que se puede revacunar una vez con la
vacuna polisacárida de 23 serotipos (VPN23) a personas
con alto riesgo de padecer enfermedad invasiva, como asplenia
funcional o anatĂłmica, insuficiencia renal crĂłnica, sĂndrome nefrĂłtico,
infecciĂłn por VIH, trasplante, leucemia, linfoma, mieloma mĂşltiple, otras
neoplasias y tratamiento inmunosupresor. Afirma, además, que las emÂbarazadas
de grupo de riesgo que no recibieron previamente VAN, pueden recibirla a partir
de la semana 16 de gestaciĂłn. Es recomendable aprovechar la oportunidad de la
VAG anual para aplicar la vacuna VAN si correspondiere. Los mayores de 65 años
no requieren orden médica para vacunarse.28
En
un documento de consenso de expertos de la AsociaciĂłn Latinoamericana del TĂłrax
(ALAT) y la Sociedad Española de NeumologĂa y CirugĂa Torácica (SEPAR), se
concluyĂł que el consumo de tabaco es un factor de riesgo muy significativo para
el desarrollo de enfermedad neumocĂłcica en sus formas
clĂnicas de neumonĂa adquirida en la comunidad (NAC) y enfermedad neumocĂłcica invasiva (ENI).29
En
nuestro medio, disponemos desde 1983 de la VPN23 (con los serotipos 1, 2, 3, 4,
5, 6B, 7 °F, 8, 9N, 9V, 10A, 11A, 12 °F, 14, 15B, 17 °F, 18 °C, 19A, 19 °F, 20,
22 °F, 23 °F y 33 °F) y de la vacuna conÂjugada de 13 serotipos (VCN13) (con
los serotipos 1, 3, 4, 5, 6A, 6B, 7 °F, 9V, 14, 18 °C, 19A, 19 °F y 23 °F), conjugados
con la proteĂna transportadora CMR 197, desde 2013. La VCN13 fue aprobada por
ANMAT para mayores de 50 años en 2012 basada en su inmunogenicidad
superior para 10 de los 12 serotipos vacunales que
comparten.30 Las vacunas antineumocĂłcicas son administradas en forma secuencial,
(VCN13 seguida de la VPN23) según la recomendación del comité de consulta sobre
prácticas de inmunización de Estados Unidos, Advisory
Committee on Immunization Practices (ACIP),
para mayores de 18 años con factores de riesgo, que incluyen candidatos y
receptores de trasplante de células hematopoyéticas. En 2014, el ACIP comenzó a
recomendar la VCN13 para adultos de 65 años de edad o más.31
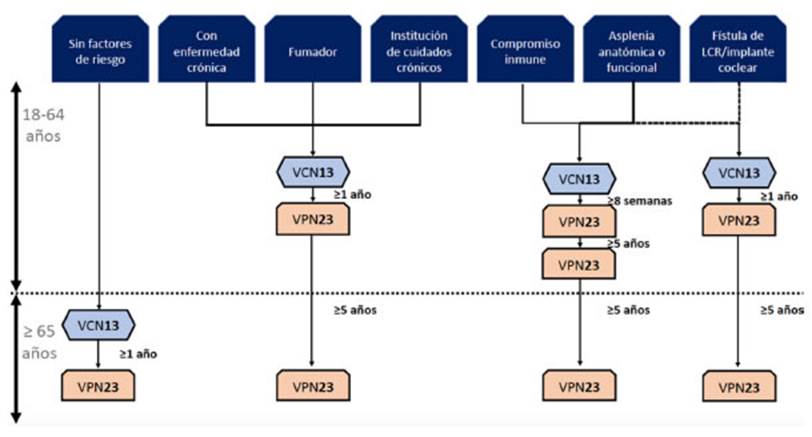
En 2015 Bonten y cols. publicaron un estudio de grupos paralelos, controlado con placebo, doble ciego aleatorizado que demostrĂł contundenteÂmente en los individuos vacunados que una dosis Ăşnica de la vacuna PCV13 tiene como resultado un 45,6% menos de primer episodio de NAC debida a alguno de los serotipos presentes en la vacuna (p < 0,001); un 45,0% menos de episodios de NAC no bacteriemia/no invasiva debida a un serotipo preÂsente en la vacuna (p = 0,007) y un 75,0% menos de primer episodio de ENI (p < 0,001).31, 32 Dunne y cols., en una revisiĂłn narrativa, compararon la efectividad de las vacunas PPV23 y PCV13 en las mismas poblaciones de adultos, y encontraron que la efectividad de la vacuna varĂa entre el 10 % y el 11% para PPV23; entre el 40 % y el 79%, para la PCV13; y el 39 % al 83% para las vacunas PCV13/PPV23. La efectividad de la vacuna contra la neumonĂa por todas las causas o la infecciĂłn del tracto respiratorio inferior varĂa entre el 8 % y 3% para PPV23 y entre el 9 % y el 12%, para PCV13. Estos datos confirman la mejor eficacia de la vacuna conjugada para prevenir la infecciĂłn pulmonar en adultos.33 La Ăşltima incorporaciĂłn es la vacuna conjugada de 20 serotipos (PCV20), que está indicada para la inmunizaciĂłn activa para la prevenciĂłn de la neumonĂa y enfermedades invaÂsivas causadas por los serotipos 1, 3, 4, 5, 6A, 6B, 7 °F, 8, 9V, 10A, 11A, 12 °F, 14, 15B, 18 °C, 19A, 19 °F, 22 °F, 23 °F y 33 °F de Streptococcus pneuÂmoniae en adultos mayores de 18 años. La PCV20 aprobada por la FDA en 2021 y por la EMEA en 2022 ha sido aprobada por la ANMAT a mediados de junio de 2023. La PCV20 agrega siete nuevos serotipos a la 13 valente, lo cual significarĂa una simplificaciĂłn de los esquemas de vacunaciĂłn en un futuro cercano.34, 35
La
vacunaciĂłn recomendada actualmente para neumococo en adultos inmunocompetentes en Argentina es la administraciĂłn
secuencial de la vacuna PCV13 seguida a los 12 meses de la VPN23. La PPV23
requiere una segunda dosis luego de los 65 años de edad (siempre y cuando hayan
transcurrido 5 años luego de la primera dosis). En aquellos pacientes
inmunocomprometidos, la administraciĂłn secuencial de PCV13 debe estar seguida
por al menos 8 semanas de la PPV23.28 En circunstancias especiales (esplenectomizados o portadores de anemia drepanocĂtica o que tienen fĂstula de lĂquido
cefalorraquĂdeo), se recomienda administrar una segunda dosis de PPV23 a los 5
años de la primera y, en estos casos, eventualÂmente, una tercera dosis luego
de los 65 años de edad36 (Figura 2).
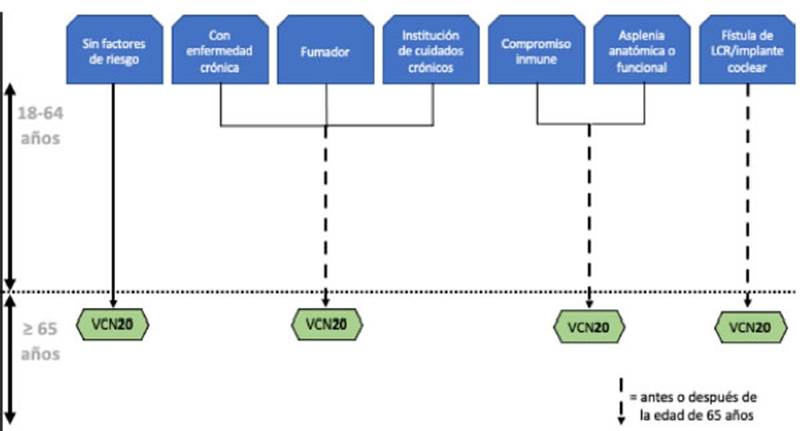
La vacunaciĂłn usando la vacuna 20-valente sugiere un esquema muy simple, como
el que se muestra en la Figura 3.
VACUNAS COVID-19
En
noviembre de 2019 se reportĂł la apariciĂłn en China de un nuevo coronavirus de
origen animal capaz de causar infecciĂłn respiratoria grave, que la OMS declarĂł
como pandemia en marzo en 2020. A principios de ese año, se logró la
secuenciaciĂłn del virus, que permitiĂł la rápida producciĂłn de vacuÂnas basadas
en vectores virales y en plataformas de ARN mensajero. Estas vacunas han
demostrado ser altamente efectivas contra formas graves de la enfermedad en
ensayos clĂnicos y de vida real, y tanto en adultos como en poblaciĂłn gestante,
pediátrica y adolescente.3,
37 Se
estima que las vacunas evitaron la muerte de diecinueve millones de personas en
el primer año de su utilización.38 Los esquemas
completos de vacunaciĂłn confieren protecciĂłn de entre el 88% y el 55% segĂşn la
vaÂriante de interĂ©s y alcanzan la mayor efectividad para la variante alfa y la
menor para Ăłmicron.39 En nuestro
paĂs, la campaña de vacunaciĂłn con las vacunas inicialmente disponibles (Sputnik V, ChadOx1 y BBBIBP-CorV)
se asociĂł a disminuÂciones significativas de infecciĂłn y mortalidad.40, 41 Al
introducirse las vacunas basadas en ARNm en niños y
adolescentes también se obtuvo un beneficio mensurable.42
La evidencia relevada por revisiones sistemáticas sugiere que las
vacunas basadas en plataforma ARNm se asocian a mayor
protección contra enfermedad sintomática.43
SegĂşn estudios observacionales se aprecia disminuciĂłn del riesgo
de apariciĂłn de sĂntomas del sĂndrome posinfecciĂłn
también conocido como long COVID entre
personas vacunadas.44 También se
comprobĂł que los esquemas heterĂłlogos conferĂan
protección y se usó esa estrategia en algunos tramos de la campaña de
vacunaciĂłn.45
El
virus ancestral fue reemplazado por nuevas variantes de mayor contagiosidad. En
noviembre de 2021, se identificĂł la variante Ăłmicron
ante la cual las vacunas inicialmente desarrolladas exhiÂbĂan menos capacidad
neutralizante y ante la cual la inmunidad decae más rápidamente.46 La aplicaÂciĂłn
de dosis de refuerzo, demostrĂł efectividad adiÂcional de una tercera dosis
comparada con el esqueÂma inicial y de una cuarta dosis contra la tercera,
principalmente en población mayor de 60 años.47, 48 Se aprecian reducciones de la efectividad
contra infecciones del 47% a los 280 d, con una efectividad del 75% a los 112 d
para prevenir internaciones y muerte.49
SegĂşn el registro federal de vacunaciĂłn, en Argentina en mayo de
2023 9 314 083 personas de 50 años o más no habĂan recibido una dosis de
refuerzo en los Ăşltimos 6 meses.50
A
principios de 2022, se introdujeron vacunas bivalentes orientadas
simultáneamente contra la variante ancestral y la nueva subvariante.51, 52 EsÂtas vacunas
han sido adoptadas como el estándar, no obstante la evidencia muestra que los
tĂtulos de anticuerpos neutralizantes que inducen son similares a los de las
vacunas monovalentes.53 En estudios
observacionales, se ha verificado que la administraciĂłn de refuerzos bivalentes
aportĂł una efectividad adicional a las dosis del esquema inicial que fue del
50% para personas entre 50 y 64 años que habĂan recibido dos dosis previamente.
En contraste, la efectividad adicional fue del 22% para mayores de 65 que habĂan
recibido más de dos dosis.54 La
explicaciĂłn de esta menor efectiviÂdad comparativa de las vacunas bivariantes serĂa el imprinting,
fenĂłmeno por el que la respuesta inmunolĂłgica se configura principalmente
contra los antĂgenos de las variantes originales que las primeras vacunas
presentaron sin lograrse una respuesta igual de eficiente al presentarse posteÂriormente
otros antĂgenos.55
La
evidencia disponible muestra que la inmuÂnidad más robusta se alcanza cuando se
combiÂnan la inmunidad adquirida por vacunaciĂłn y la natural por infecciĂłn,
situaciĂłn muy frecuente al considerar la alta prevalencia de infecciĂłn en las
comunidades.56 Las
recomendaciones vigentes del MSAL al momento de la escritura de este documenÂto
establecen que quienes se encuentren dentro de grupos con alto riesgo de
desarrollar formas graves de enfermedad (personas de 50 años o maÂyores,
personas con inmunocompromiso y personas gestantes)
reciban una dosis de refuerzo contra COVID-19 si han transcurrido seis meses
desde la Ăşltima dosis aplicada, independientemente de la cantidad de refuerzos
recibidos previamente y respetando el intervalo mĂnimo de al menos cuatro meses
desde la última dosis. Las personas menores de 50 años con comorbilidades (enfermedades
crĂłÂnicas y obesidad) y las personas con mayor riesgo de exposiciĂłn (personal
de salud) y funciĂłn estraÂtĂ©gica se incluyen en el grupo de “riesgo medio” de
experimentar enfermedad grave o muerte por infecciĂłn por COVID-19. La
recomendaciĂłn para este grupo es que reciban un nuevo refuerzo a los seis meses
de la Ăşltima dosis aplicada y, posteriorÂmente, un refuerzo anual.
Las
personas consideradas con bajo riesgo de complicaciones (menores de 50 años sin
comorbiliÂdades) tienen disponible la vacunaciĂłn de refuerzo contra la COVID-19
y se recomienda que su apliÂcaciĂłn sea anual.50
Los
efectos adversos de la vacunaciĂłn más freÂcuentes son reacciones locales leves.57 Los efectos
adversos más preocupantes reportados han sido la aparición de trombosis (principalmente
asociado con la vacuna ChadOx1) y la de miocarditis (vinÂculados con las
vacunas de plataforma ARNm). Si bien se verifican
aumentos modestos de riesgo de eventos hematolĂłgicos y vasculares tras la vacuÂnaciĂłn,
este riesgo es mucho mayor y prolongado para la infecciĂłn por el virus.58, 59 Las
miocarditis son eventos muy raros que se registran en 1,08 casos por cada 100
000 personas vacunadas, y son graves en uno de cada 5 eventos.60
También, en este caso, es más frecuente la miocarditis por la infección
por SARS-CoV-2 que por la vacunaciĂłn, por lo que la relaciĂłn riesgo/beneficio
resulta alÂtamente favorable a la vacunaciĂłn.61
VACUNAS CONTRA PERTUSSIS
La
tos ferina o convulsa, o tambiĂ©n llamada «coÂqueluche», es causada por la
bacteria Bordetella pertussis.
La enfermedad clásica respiratoria se caracteriza por tres fases: catarral,
paroxĂstica y de convalecencia.62 Durante la
fase catarral, las personas infectadas experimentan coriza (inflamaÂciĂłn de las
membranas mucosas de las cavidades nasales), tos ocasional leve y fiebre baja.
La fase paroxĂstica se caracteriza por tos espasmĂłdica, vĂłmitos luego de la tos
y sibilancias inspiratorias. Los sĂntomas mejoran lentamente durante la fase de
convalecencia, que generalmente dura de 7 d a 10 d, pero puede durar meses. Los
factores que afectan la presentaciĂłn clĂnica de la tos ferina inÂcluyen la
edad, el nivel de inmunidad, el historial de vacunaciĂłn y el uso de
antibiĂłticos al comienzo de la enfermedad.63
El
MSAL recomienda la vacunaciĂłn conjunta contra pertussis,
tétanos, difteria, Haemophilus influenzae tipo b y hepatitis B para bebés y niños
pequeños, a travĂ©s de una serie de cuatro dosis de vacuna quĂntuple o
pentavalente donde están inÂcluidos los toxoides diftĂ©ricos, tetánico y pertussis acelular
(en Argentina, se dispone del componente celular). Se continĂşa con una dosis de
DTP (triple bacteriana celular) al ingreso escolar (5 años de edad).5 Luego también
el ACIP recomienda conÂtinuar con una dosis de refuerzo a los 11 años de la
vacuna dTpa (vacuna triple bacteriana acelular con toxoide diftérico reducido, toxoide tetánico y
pertussis acelular).
A los adultos de 19 a 64 años que nunca hayan recibido la vacuna dTpa también se les recomienda recibir una dosis de
refuerzo. Durante el embarazo, se aconseja que las mujeres reciban una dosis de
dTpa después de la semana 20, preferentemente entre
las semanas 27 y 36 sin importar si ya han recibido previamente esta vacuna.
Después de recibir la vacuna dTpa, se sugiere que los
adolescentes y adultos reciban una dosis de refuerzo de la vacuna Td (toxoides tetáÂnico y diftĂ©rico) cada 10 años para
garantizar una protección continua contra el tétanos y la difteria y reducir la
transmisiĂłn de esta Ăşltima.5,
64
Recientemente,
las guĂas GOLD (Global IniÂtiative for Chronic Obstructive
Lung Disease)
recomiendan la vacunaciĂłn con dTpa a pacientes con
enfermedad pulmonar obstructiva crĂłnica que no fueron vacunadas en la
adolescencia.65
VACUNA CONTRA HERPES
ZĂ“STER
El
herpes zóster (HZ) es una enfermedad neuro-cutánea
producida por la reactivaciĂłn de la inÂfecciĂłn primaria por el virus de la
varicela-zĂłster (VZV). Esto tiene como resultado la varicela, que continĂşa con
la residencia de por vida del genoma VZV en la raĂz dorsal o nervio craneal de
los ganÂglios.66 La incidencia
y gravedad del HZ aumentan con la edad. Más del 90% de los pacientes mayores de
50 años en todo el mundo han sido infectados con VZV y, por ende, están en
riesgo de desarrollar HZ, con una incidencia de aproximadamente de entre 2 y
4,6 personas por cada 1000 al año.67-70 La incidencia
aumenta significativamente en adultos mayores de 80 años y llega a valores
entre 10 y 12,8 casos por cada 1000 personas-año.71
Ello implica que una de cada tres personas entre 50 y 90 años
sufrirá algún episodio de HZ.72 La inmunidad
al HZ, que se adquiere por primera vez de manera innata (primoinfecciĂłn)
en niños y adultos jóvenes cuando adquieren varicela, puede mantenerse en forma
intrĂnseca o a travĂ©s de refuerzo extrĂnseco. La forma intrĂnseca es en respuesta
subclĂnica a la reactivaciĂłn de VZV y el refuerzo extrĂnseco se da de forma
asintomática por exposición al VZV en la comunidad.72, 79 El riesgo de HZ aumenta en personas de 50 años
o más debido a los efectos de la inmunosenescencia
(envejecimiento celular) o, a cualquier edad, por inmunosupresiĂłn debido a
diversas enfermedades, como el VIH, diabeÂtes mellitus, EPOC,
insuficiencia renal crĂłnica, enfermedad cardiovascular, entre otras; o por
tratamientos inmunosupresores, como los trataÂmientos quimioterápicos
en la poblaciĂłn oncolĂłÂgica, trasplantes, enfermedades reumatolĂłgicas o
enfermedades del intersticio pulmonar.70
El HZ se produce cuando la inmunidad mediada por células
especĂficas de VZV no logra contener la reactivaÂciĂłn viral, presumiblemente,
por caer por debajo de un umbral de protecciĂłn aĂşn no definido, y el VZV
reactivado continúa propagándose.73,
74 El
HZ presenta múltiples complicaciones; la neuralgia posherpética
(10%-15%) es la más frecuente. Se caracteriza por dolor crónico radicular que
puede prolongarse hasta más de 3 meses después de la erupción vesicular del HZ
y llegar a ser discapaciÂtante y muy difĂcil de
tratar. Los dolores crónicos de la neuralgia posherpética
pueden afectar entre el 5% y el 30% de las personas que desarrollan HZ, aunque
es más frecuente en las personas de mayor edad, especialmente a partir de los
60 años.70, 75 Si afecta la
región ocular, especialmente posterior a un HZ oftálmico, puede complicarse con
queratiÂtis, conjuntivitis e, incluso, glaucoma, que pueden cicatrizar y dejar
lesiones graves como distintos grados de ceguera. En pacientes con inmunosupreÂsiĂłn
grave puede haber complicaciones graves y de alta mortalidad, como el HZ
diseminado, mielitis, encefalitis o parálisis de nervios craneales.76 En la versión
anterior del documento, se recomendĂł la vacuna a virus vivo atenuado contra el
HZ que contiene la cepa Oka VZV. Esta vacuna está
autorizada para su uso en adultos de 50 años de edad en adelante. En la
bibliografĂa mĂ©dica, esta vacuna ha demostrado una eficacia del 51,3% en la
prevención del HZ y un 66,5% de eficacia en la reducción de la neuralgia posherpética en personas de 60 años o más. Sin embargo, se
ha observado que su eficacia disminuye con la edad, pasando de un 69,8% en
adultos de entre 50 y 59 años a un 37,6% en aquellos de 70 años o más. Además,
está contraindicada en personas con inmunosupresión, ya que las vacunas vivas
atenuadas podrĂan causar enfermedades en esta poblaciĂłn.77
En 2015, se introdujo una nueva recomendaciĂłn y, en 2017, la FDA
votó en forma unánime para recomendar una nueva vacuna recombinante que
contiene como antĂgeno, una glicoproteĂna llamada “gE”
(fragÂmento del VZV) más un adyuvante para despertar la respuesta inmune
llamada “AS 01B”. Dos dosis separadas por 2-6 meses tienen una eficacia del
97,2% en reducir el riesgo de HZ en adultos de 50 años o más.75, 77 Se ha estudiado la duración de su eficacia con
el paso de los años, que mantiene un 87,9% para prevención de HZ luego de 4
años de haber recibido dos dosis.71 Muchos asmáticos y casi la
totalidad de los pacientes con EPOC, fibrosis pulmonar idiopática y otras
afecciones pulmonares crónicas tienen más de 50 años de edad, que es la edad a
partir de la cual se recomienda el uso de esta vacuna.1 Ya que es
habitual que en los adultos no exista una cultura acerca de la vigilancia de
cumplimiento con las vacunas indicadas, el neumonĂłlogo
puede considerarse uno de los agentes de salud que mejor podrĂa en su práctica
recomendar esta vacuÂna dentro de las medidas de prevenciĂłn en salud a sus
pacientes, lo que influye positivamente en las actitudes y creencias de sus
pacientes.78
VACUNA CONTRA VIRUS
SINCICIAL RESPIRATORIO
El
virus sincicial respiratorio es una causa freÂcuente de
infecciones del tracto respiratorio, que puede causar enfermedad grave y se
presenta frecuentemente en lactantes y adultos mayores. Durante el invierno, se
estiman entre 700 000 y dos millones de casos de VSR. En los Estados Unidos,
las infecciones por VSR en adultos maÂyores representan aproximadamente 177 000
hospitalizaciones y 14 000 muertes anuales.79
En Argentina, hay aproximadamente 7 000 000 de adultos mayores de
65 años, un 0,2% de ellos va a padecer una infección grave por VSR, unos 14 000
pacientes en promedio.80 Las
neumonĂas, exacerbaÂciones de EPOC o asma son causa de internaciĂłn en pacientes
que adquieran una infección grave por VSR. Además, un 10% de estos pacientes
van a fallecer como consecuencia de esta infecciĂłn.81
En muchos casos, los niños son la fuente de inÂfecciones para los
adultos mayores, mientras que, en otros casos, son los niños quienes se
contagian a partir de los adultos mayores. Recientemente, la FDA aprobĂł una
vacuna contra el VSR para adultos. La eficacia de esta vacuna fue del 94,1%
(intervalo de confianza del 95%, 62,4 a 99,9) frente a la enfermedad grave
(neumonĂa) y del 71,7% (IC del 95%, 56,2 a 82,3) frente al VSR que
produce reagudizaciĂłn de enfermedad respiratoria relaÂcionada.82
En Argentina, esta vacuna aĂşn no ha sido presentada ante la ANMAT
y, por ende, no se encuentra disponible aĂşn.
RECOMENDACIONES DE
VACUNACIĂ“N EN EL ADULTO POR EL NEUMONĂ“LOGO
Las
vacunas son importantes para prevenir enÂfermedades y sus complicaciones a lo
largo de la vida. Sin embargo, la cobertura de vacunaciĂłn en adultos es baja en
general y está lejos de alcanzar las metas establecidas. Entre las vacunas
recomenÂdadas para adultos, se destacan aquellas contra la influenza y el
neumococo, que buscan prevenir complicaciones respiratorias. En pacientes con
enfermedades pulmonares crĂłnicas, como EPOC, asma y bronquitis crĂłnica, estas
vacunas son especialmente importantes. Este comité propone que, además de las
indicaciones especĂficas del calendario de vacunaciĂłn, se sigan las recomendaÂciones
del Ministerio de Salud y otros organismos para simplificar las indicaciones de
vacunaciĂłn en adultos segĂşn las distintas edades, siempre traÂtando de ampliar
dichas indicaciones, pero nunca acortándolas.
INDICACIONES DE
VACUNACIĂ“N EN PATOLOGĂŤAS ESPECĂŤFICAS
Asma bronquial
El
asma es una enfermedad crĂłnica de las vĂas respiratorias caracterizada por una
inflamación persistente en la que diferentes tipos de células juegan un papel
importante. Esta inflamaciĂłn causa sĂntomas en personas sensibles, asociados
con una obstrucciĂłn variable pero generalizada del flujo de aire, que puede
revertirse espontáneaÂmente o con tratamiento. Además, la inflamaciĂłn tambiĂ©n
aumenta la hiperreactividad bronquial ante diversos estĂmulos.83
Todos los pacientes asmáticos se encuentran comprendidos entre
las enfermedades pulmonares crĂłnicas, reconocidas entre las indicaciones de VAG
anual y COVID-19 según los lineamientos dispuestos por MSAL y la Global Initiative for Asthma (GINA) 2022 (9, 79). El CDC a través de la agenda de
inmunizaciĂłn 2030 (Healthy People
2030) plantea como principales objetivos reducir la morbilidad y mortalidad de
enfermedades prevenibles mediante la vacunaciĂłn y, para ello, garantizar el
acceso a vacunas nuevas y existentes a toda la poblaciĂłn. La inmunizaciĂłn es
una historia de éxito para la salud a nivel mundial. Desde 2010, más de 116
paĂses han introducido vaÂcunas que no utilizaban anteriormente, alguna de
ellas dirigidas contra afecciones mortĂferas, como la NAC.84
En una revisión sistemática realizada por Boikos
et al., se encontrĂł una asociaciĂłn positiva entre el asma y la ENI. Este
hallazgo respalda la inclusiĂłn del asma como una enfermedad de alto riesgo que
requiere la administraciĂłn de inmuniÂzaciĂłn contra el neumococo.85 Por lo
anteriormente citado, documentos de consenso de expertos, la guĂa española de
manejo del asma (GEMA 5.3) y el CDC se recomienda la administraciĂłn de VAN en
pacientes con asma.86,
87
Enfermedad pulmonar
obstructiva crĂłnica
Es
una enfermedad heterogĂ©nea caracterizada por sĂntomas respiratorios crĂłnicos
(tos, disnea, producciĂłn de esputo o exacerbaciones) debidos a anormalidades de
las vĂas aĂ©reas o los alvĂ©olos que causan obstrucciĂłn de las vĂas aĂ©reas.65 Las
exacerbaciones son principalmente causadas por infecciones virales que pueden sobreinfectarse con bacterias y originan un aumento de la
inflamaciĂłn que provoca sĂntomas e impacta en la calidad de vida y la
sobrevida. Las personas con EPOC tienen más frecuentemente NAC y la EPOC se
asocia a menor sobrevida tras un episodio de NAC.88
La EPOC es la enfermedad pulmonar crĂłnica por excelencia
reconocida entre las indicaciones de VAG anual y VAN en los lineamientos
tĂ©cnicos de la DirecciĂłn Nacional de Control de Enfermedades Inmunoprevenibles y del Ministerio de Salud y GĂ©Ânero de la
Ciudad AutĂłnoma de Buenos Aires.89 Las VAG y VAN
se recomiendan con distintos niveles de evidencia en las guĂas GOLD, en la guĂa
española GesEPOC y en la guĂa nacional de diagnĂłstico
y tratamiento de la EPOC del MSAL.90,
91 La
VAG con virus inactivados parece reducir la frecuencia de exacerbaciones y de
enfermedad grave que reÂquiere internaciones.92, 93 Es tambiĂ©n efectiva para disminuir el nĂşmero
de infecciones por influenza en un 40% y podrĂa asociarse con menor riesgo de
eventos cardĂacos isquĂ©micos.94,
95 En
tĂ©rminos de eficacia, los resultados de una evaluaciĂłn de la eviÂdencia indican
que la probabilidad de no adquirir infecciones respiratorias agudas
relacionadas con influenza en sujetos vacunados con VAG (trivalenÂte, virus
fragmentado e inactivado) es del 76%. En los pacientes con EPOC leve, moderado
o grave, la efectividad de la vacuna fue del 84%, 45% y 85%, respectivamente.96 La evidencia
de las revisiones sistemáticas no ha demostrado efecto de la VAG en la mortalidad,
el nĂşmero de internaciones por enfermedad tipo influenza o la necesidad de venÂtilaciĂłn
mecánica.92,
96 Las
guĂas antes mencionaÂdas coinciden en recomendar la VAN por ser una de las
comorbilidades incluidas en la indicaciĂłn emitida por los CDC. Una revisiĂłn
sistemática de la colaboración Cochrane encontró que la VAN reduce la
incidencia de NAC y de exacerbaciones en pacientes con EPOC.97
Asimismo encontraron que la vacunaciĂłn reduce el riesgo de NAC y
de exacerbaciones de EPOC sin impactar en el riesgo de neumonĂa neumocĂłcica confirmada.97, 98 Con respecto a la seguridad, los efectos
adversos locales y sistémicos reportados son leves.92, 97, 98
Tabaquismo
Existe
evidencia de estudios poblacionales de mayor riesgo de enfermedad tipo influenza
(ETI) entre fumadores. Una encuesta realizada en 5943 sujetos en Gran Bretaña
encontrĂł que el tabaco era uno de los seis factores asociados a ETI en el
análisis multivariable.99 El consumo de
tabaco es, independientemente de la edad, la presencia de comorbilidades y el
estado inmunitario, indicaciĂłn formal de vacunaciĂłn VAG y VAN, aunque no exisÂtan
otros factores de riesgo.29,
100, 101
Otras enfermedades
pulmonares crĂłnicas
Las
exacerbaciones agudas de enfermedades pulÂmonares crĂłnicas suelen estar
asociadas con patĂłÂgenos virales y bacterianos. Estas exacerbaciones
contribuyen al deterioro de la funciĂłn pulmonar, a una mala calidad de vida y
generan una carga adicional para individuos, familias, comunidades y el sector
de la salud. Por lo tanto, prevenir las exacerbaciones es importante en el
manejo clĂnico. Existen varias vacunas que ofrecen protecciĂłn contra patĂłgenos
respiratorios (Streptococcus pneumoniae, Bordetella
pertussis, influenza, VSR y SARS-CoV-2) que
pueden desencadenar exacerbaciones, pero la evidencia que respalda su
efectividad en la prevenciĂłn de exacerbaciones de enfermedades pulmonares
crĂłnicas es limitada.102 La mayorĂa de
las investigaciones se enfocan en otras enfermedades pulmonares crĂłnicas, como la
EPOC, el asma y la fibrosis quĂstica. Las bronquiectasias reciben menos
atenciĂłn en comÂparaciĂłn con otras enfermedades respiratorias crĂłnicas en niños
y adultos. El papel de las vacunas existentes dirigidas a los patĂłgenos
asociados con la enfermedad no ha sido suficientemente estuÂdiado y la
evidencia de beneficio es limitada.103 A pesar de
esto, debido al riesgo de complicaciones, como neumonĂa grave, ENI y
hospitalización por influenza, se recomienda que los niños y adultos con BQT
reciban las vacunas de acuerdo con el programa nacional de inmunizaciĂłn para
grupos de alto riesgo.5 También es
importante considerar el papel de la inmunizaciĂłn materna durante el embarazo,
ya que las infecciones respiratorias graves en la primera infancia están
asociadas con el desarrollo de bronquiectasias.
RECOMENDACIONES DE
VACUNACIĂ“N PARA EL NEUMONĂ“LOGO
Teniendo
en consideraciĂłn los antecedentes y la edad, apoyados en la disponibilidad de
las distinÂtas vacunas, las recomendaciones del MSAL y las publicaciones recientes,
la SecciĂłn Infecciones PulÂmonares de la AsociaciĂłn Argentina de Medicina
Respiratoria formula las siguientes recomendacioÂnes para el neumonĂłlogo respecto de la vacunaciĂłn de adultos con
enfermedades pulmonares.
Mayores
de 18 años y menores de 65 años, sin antecedentes de enfermedad pulmonar y sin
contacto cercano con personas con alto riesgo de complicaciones si se contagian
de influenza
Pueden
recibir VAG anual, preferentemente tetraÂvalente (dos cepas de virus A y dos
cepas de virus B), aun cuando no tengan una indicaciĂłn precisa. Interrogarlos
acerca de su Ăşltima vacunaciĂłn con la vacuna dT que
debe repetirse cada 10 años. Se recomienda que alguna de las dosis de vacuna dT a aplicarse a lo largo de la vida sea realizada con la
vacuna dTpa si el paciente nunca se hubiera realizado
vacunaciĂłn con vacuna acelular para pertussis. Pueden recibir VAC esquema inicial y un
refuerzo anual.
Mujeres
que estén cursando un embarazo:
VAG
(está indicada durante cualquier trimestre del embarazo), vacuna dPTa (después de la 20.ª semana de
gestaciĂłn en cada embarazo).
Mayores
de 18 años y menores de 65 años, con antecedentes de enfermedad pulmonar o
tabaquismo, u otras comorbilidades, o con contacto con pacientes de alto riesgo
de sufrir complicaciones si contraen influenza:
VAG
anual, preferentemente tetravalente, VAN segĂşn el esquema presente en la Figura
2. InteÂrrogarlos acerca de su Ăşltima vacunaciĂłn con la vacuna dT que debe repetirse cada 10 años. Se reÂcomienda que
alguna de las dosis de vacuna dT que van a aplicarse
a lo largo de la vida sea realizada con la vacuna dTpa
si el paciente nunca se hubiera realizado vacunaciĂłn con vacuna acelular contra pertussis.
Pueden recibir VAC esquema inicial con refuerzos cada 6 meses.
Mayores
de 18 años y menores de 65 esplenectomizados o
portadores de anemia drepanocĂtica o que tienen
fĂstula de lĂquido cefalorraquĂdeo:
VAG
anual, preferentemente tetravalente, VAN segĂşn el esquema presente en la Figura
2. Vacuna dT cada 10 años. Se recomienda que alguna de
las dosis de vacuna dT que va a aplicarse a lo largo
de la vida sea realizada con la vacuna dTpa si el
paciente nunca se hubiera realizado vacunaciĂłn con vacuna acelular
para pertussis (Figura 1). Pueden
recibir VAC esquema inicial con refuerzos cada 6 meses.
Adultos
de entre 50 y 65 años, sanos:
Solo
tienen indicado en el calendario la aplicación de la vacuna doble dT cada 10 años a lo largo de la vida. Se recomienda que
alguna de las dosis de dicha vacuna sea realizada con la vacuna dTpa. Los mayores de 50 años sanos tienen indicación de
vacunaciĂłn contra HZ. La vacuna recombinante se aplica en 2 dosis separadas por
entre 2 y 6 meses.
Mayores
de 65 años, con comorbilidades o sin estas:
VAG
anual, preferentemente tetravalente o trivaÂlente adyuvantada
y VAN segĂşn el esquema preÂsente en la Figura 2. Vacuna dT
cada 10 años. Se recomienda que alguna de las dosis de vacuna dT que va a aplicarse a lo largo de la vida sea realizada
con la vacuna dTpa si el paciente nunca se hubiera
realizado vacunaciĂłn con vacuna acelular para pertussis. Si no han sido vacunados aĂşn contra el HZ
tienen indicaciĂłn de hacerlo. Pueden recibir VAC esquema inicial con refuerzos
cada 6 meses.
Pacientes
de cualquier edad internados en terapia intensiva con insuficiencia respiratoria
o con insuficiencia cardĂaca:
Vacuna
contra el herpes zĂłster. VAG anual, prefeÂrentemente tetravalente, VAN segĂşn el
esquema presente en la Figura 2. Vacuna dT cada 10
años. Se recomienda que alguna de las dosis de vacuna dT
que va a aplicarse a lo largo de la vida sea realizada con la vacuna dTpa si el paciente nunca se hubiera realizado vacunaciĂłn
con vacuna acelular para pertussis.
Si no han sido vacunados aĂşn contra el HZ tienen indicaciĂłn de hacerlo. Pueden
recibir VAC esquema inicial y un refuerzo anual.
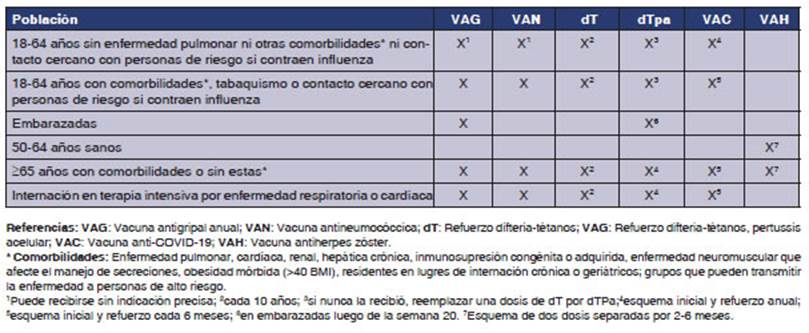
La
Tabla 1 recoge un resumen de las recomenÂdaciones.
CONCLUSIONES
Las
enfermedades respiratorias crĂłnicas son un problema de salud creciente,
especialmente en lo relacionado con el consumo de tabaco y el envejeÂcimiento
de la poblaciĂłn asociado a la constante actualizaciĂłn en las inmunizaciones y
profilaxis en todos los individuos con factores de riesgo y sin estos. Esto se
convierte en una paradoja derivada de los avances en la atención médica durante
las últimas décadas.
En
este escenario, el neumonĂłlogo juega un papel
fundamental como referente, en especial luego de la emergencia del COVID-19,
donde muchas especialidades derivaban a la consulta por el especialista para
consultar sobre las nueÂvas vacunas, coadministraciĂłn con VAG y VAN y otras
vacunas, tiempos entre dosis, entre otros interrogantes.
Además,
el neumonólogo también se enfrenta a las
consecuencias de la falta de prevenciĂłn de infecciones respiratorias, como
exacerbaciones de EPOC, de asma, NAC y otros trastornos inÂfecciosos. Como
resultado, el neumonólogo es el especialista que más
prescribe e informa sobre vacunas como mejor mĂ©todo de prevenciĂłn para enÂfermedades
infecciosas en enfermedades crĂłnicas.
Es
objetivo de este comité redactor promover la actualización constante de los neumonólogos de adultos para que estén preparados para
desempeÂñar un papel directo como agentes en la recomenÂdaciĂłn de vacunas a sus
pacientes.
Conflictos
de interés
CML
es mĂ©dico consultor de Pfizer, desde 2012; ha partiÂcipado en protocolos de
ensayos clĂnicos como investigaÂdor, adjudicador, o miembro del Board safety monitoring board para Novartis, Boehringer, Bayer y Pfizer en el pasado; es disertante para
Pfizer desde 2010. LP ha parÂticipado como disertante para Glaxo
sobre enfermedades obstructivas en adultos y como consultor para Merck Sharp
& Dohne. AJV se ha desempeñado como consultor de
Sanofi, GSK, Novartis y Pfizer. El resto de los
autores no tienen conflictos de intereses relacionados con el tema de esta
publicaciĂłn.
FinanciaciĂłn
del Documento
Son
auspiciantes de este documento los laboratorios SAÂNOFI, Pasteur y SEQUIRUS.
BIBLIOGRAFĂŤA
1.
Luna CM, Rizzo O, Monteverde A, et al. Recomendaciones de vacunaciĂłn en adultos
con enfermedades respiratoÂrias. Documento de la AsociaciĂłn Argentina de
Medicina Respiratoria para los neumonĂłlogos. Rev Am Med Resp. 2015;4:314-24.
2. Roser
M, Ortiz-Ospina E, Ritchie H. Life Expectancy. Our World in Data [Internet]. 2013 May 23 [cited 2023 Jun
5]; https://ourworldindata.org/life-expectancy
3. Shi T, Robertson C, Sheikh A.
Effectiveness and safety of coronavirus disease 2019 vaccines. Curr Opin Pulm Med [Internet].
2023;29(3):138-42.
http://dx.doi.org/10.1097/MCP.0000000000000948
4. Luna CM. Impact of vaccination
on the epidemiology and prognosis of pneumonia. Rev Esp Quimioter [Internet].
2022;35(Suppl 1):104-10.
http://dx.doi.org/10.37201/req/s01.22.2022
5.
Ministerio de Salud de la NaciĂłn, Argentina. Calendario Nacional de VacunaciĂłn
[Internet]. [cited 11 de
junio de 2023].
https://bancos.salud.gob.ar/recurso/calendario-nacional-de-vacunacion-2022.
6. Theilacker
C, Sprenger R, Leverkus F,
Walker J, Häckl D, von Eiff
C, et al. Population-based incidence and mortality of community-acquired
pneumonia in Germany. PLoS One [Internet]. 2021;16:e0253118.
http://dx.doi.org/10.1371/journal.pone.0253118
7. Jain S, Self WH, Wunderink RG, Fakhran S, Balk R, Bramley AM, et al. Community-Acquired Pneumonia Requiring
Hospitalization among U.S. Adults. N Engl
J Med [Internet]. 2015;373:415-27.
http://dx.doi.org/10.1056/NEJMoa1500245
8. Vaccination coverage among
adults in the United States, national health interview survey, 2019-2020.
Centers for Disease Control and Prevention
9. COVID-19 Excess Mortality
Collaborators. Estimating excess mortality due to the
COVID-19 pandemic: a systematic analysis of COVID-19-related mortality,
2020-21. Lancet [Internet]. 2022;399:1513-36.
http://dx.doi.org/10.1016/S0140-6736(21)02796-3
10.
DirecciĂłn de Control de Enfermedades Inmunoprevenibles.
GuĂa Rápida VacunaciĂłn Antigripal. Ministerio de Salud de Argentina; 2023.
11.
Talledo M, Zumaeta K. Los virus Influenza y la nueva
pandemia A/H1N1. Rev Peru Biol [Internet]. 2009;16:227- 38.
http://www.scielo.org.pe/scielo.php?pid=S1727-99332009000200018&script=sci_arttext
12.
Carascal MB, Pavon RDN,
Rivera WL. Recent Progress in Recombinant Influenza Vaccine
Development Toward Heterosubtypic
Immune Response. Front Immunol [Internet]. 20229;13:878943. http://dx.doi.org/10.3389/fimmu.2022.878943
13. Centers for Disease Control
and Prevention. Recommended Adult Immunization Schedule for
ages 19 years or older [Internet]. U. S. Department of Health and Human
Services; 2023. https://www.cdc.gov/vaccines/schedules/hcp/imz/adult.html
14. A revision of the system of
nomenclature for influenza viruses: a WHO memorandum. Bull World Health Organ
[Internet]. 1980;58:585-91.
https://www.ncbi.nlm.nih.gov/pubmed/6969132
15. Scheduler EV. Vaccine
schedules in all countries in the European Union. May 27]
https://vaccine-schedule ecdc europa
eu. 2020;
16.
Robertson CA, DĂaz Granados CA, Decker MD, Chit A, Mercer M, Greenberg DP. Fluzone®
High-Dose Influenza Vaccine.
Expert Rev Vaccines [Internet]. 2016;15):1495- 505.
http://dx.doi.org/10.1080/14760584.2016.1254044
17. Johansen ND, Modin D, Nealon J, Samson S, Salamand C, Larsen CS, et al. Feasibility of randomizing
Danish citizens aged 65-79 years to high-dose quadrivalent
influenza vaccine vs. standard-dose quadrivalent
influenza vaccine in a pragmatic registry-based setting: rationale and design
of the DANFLU-1 Trial. Pilot Feasibility Stud [Internet]. 2022;8:87. http://dx.doi.org/10.1186/s40814-022-01044-w
18. Kim EH, Kwon HI, Park SJ, Kim
YI, Si YJ, Lee IW, et al. Generation of a High-Growth Influenza Vaccine Strain
in MDCK Cells for Vaccine Preparedness. J Microbiol Biotechnol [Internet]. 2018;28:997-1006.
http://dx.doi.org/10.4014/jmb.1712.12007
19. Gresset-Bourgeois
V, Leventhal PS, Pepin S, Hollingsworth R, Kazek-Duret MP, De Bruijn I, et
al. Quadrivalent inacÂtivated influenza vaccine (VaxigripTetraTM). Expert Rev Vaccines [Internet]. 2018;17:1-11. http://dx.doi.org/10.10 80/14760584.2018.1407650
20. Liu X, Park J, Xia S, et al.
Immunological non-inferiority and safety of a quadrivalent
inactivated influenza vaccine versus two trivalent inactivated influenza
vaccines in China: Results from two studies. Hum Vaccin
Immunother [Internet]. 2022;18:2132798.
http://dx.doi.org/10.1080/216 45515.2022.2132798
21. Varkey
JB, Varkey AB, Varkey B.
Prophylactic vaccinations in chronic obstructive pulmonary disease: current
status. Curr Opin Pulm Med
[Internet]. 2009;15:90-9.
http://dx.doi.org/10.1097/MCP.0b013e3283218356
22. Gentile A, Paget J, Bellei N, Torres JP, et al. Influenza in Latin America: A
report from the Global Influenza InitiaÂtive (GII). Vaccine
[Internet]. 2019;37:2670-8.
http://dx.doi.org/10.1016/j.vaccine.2019.03.081
23. Hirve
S, Newman LP, Paget J, et al. Influenza Seasonality in the Tropics and
Subtropics - When to Vaccinate? PLoS One [Internet]. 2016;11:e0153003.
http://dx.doi.org/10.1371/journal.pone.0153003
24. Centers for Disease Control
and Prevention. CDC Seasonal Flu Vaccine Effectiveness Studies [Internet]. [cited 11 de junio de 2023].
https://www.cdc.gov/flu/vaccines-work/effectiveness-studies.htm
25. Thompson MG, Pierse N, Sue Huang Q, et al. Influenza vaccine
effectiveness in preventing influenza-associated intensive care admissions and
attenuating severe disÂease among adults in New Zealand 2012-2015. Vaccine [Internet]. 2018;36:5916-25.
http://dx.doi.org/10.1016/j.vaccine.2018.07.028
26. Ferdinands
JM, Thompson MG, Blanton L, Spencer S, Grant L, Fry AM. Does influenza
vaccination attenuate the severity of breakthrough infections? A narrative review and recommendations for further research.
Vaccine [Internet]. 2021;39:3678-95.
http://dx.doi.org/10.1016/j.vaccine.2021.05.011
27. Musher DM, Abers MS, Bartlett JG. Evolving
UnderstandÂing of the Causes of Pneumonia in Adults, With Special Attention to
the Role of Pneumococcus. Clin Infect
Dis [Internet]. 2017;65:1736-44.
http://dx.doi.org/10.1093/cid/cix549
28.
DirecciĂłn de Control de Enfermedades Inmunoprevenibles.
VacunaciĂłn contra Neumococo. Lineamientos TĂ©cnicos. Manual del Vacunador.
Ministerio de Salud de Argentina; 2018.
29.
Jiménez Ruiz CA, Buljubasich D, Sansores R, et al.
Documento de consenso SEPAR-ALAT sobre vacunaciĂłn antineumocĂłcica
en fumadores. Arch Bronconeumol [Internet]. 2015;51:350-4.
https://www.sciencedirect.com/science/article/pii/S0300289614004888
30. Jackson LA, Gurtman A, Rice K, Pauksens K, et
al. ImÂmunogenicity and safety of a 13-valent pneumococcal conjugate vaccine in
adults 70 years of age and older previously vaccinated with 23-valent
pneumococcal polysaccharide vaccine. Vaccine [Internet].
2013;31:3585-93.
http://dx.doi.org/10.1016/j.vaccine.2013.05.010
31. Tomczyk
S, Bennett NM, Stoecker C, et al. Use of 13-valent
pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide
vaccine among adults aged ≥65 years: recommendations of the Advisory
Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep [Internet].
2014;63:822-5. https://www.ncbi.nlm.nih.gov/pubmed/25233284
32. Bonten
MJM, Huijts SM, Bolkenbaas
M, et al. PolysacchaÂride conjugate vaccine against pneumococcal pneumonia in
adults. N Engl J Med [Internet].
2015;372:1114-25.
http://dx.doi.org/10.1056/NEJMoa1408544
33. Dunne EM, Cilloniz
C, von Mollendorf C, et al. PneumoÂcoccal Vaccination
in Adults: What Can We Learn From Observational
Studies That Evaluated PCV13 and PPV23 Effectiveness in the Same Population? Arch Bronconeumol [Internet]. 2023;59:157-64. http://dx.doi.org/10.1016/j.arbres.2022.12.015
34. Vaccines for Pneumococcal
[Internet]. 2023 [cited 2023 Jul 4].
https://www.cdc.gov/vaccines/vpd/pneumo/index.html
35. Essink
B, Sabharwal C, Cannon K, Frenck
R, Lal H, Xu X, et al.
Pivotal Phase 3 Randomized Clinical Trial of the Safety, Tolerability, and
Immunogenicity of 20-Valent Pneumococcal Conjugate Vaccine in Adults Aged ≥18
Years. Clin Infect Dis [Internet]. 2022;75:390-8.
http://dx.doi.org/10.1093/cid/ciab990
36.
ComisiĂłn Nacional de Inmunizaciones. Lineamientos tĂ©cÂnicos para la vacunaciĂłn
de personas inmunodeprimidas (huéspedes especiales). Ministerio de Salud de Argentina; 2014.
37. Zheng
C, Shao W, Chen X, Zhang B, Wang G, Zhang W. Real-world effectiveness of
COVID-19 vaccines: a literature review and meta-analysis. Int
J Infect Dis [Internet]. 2022;114:252-60.
http://dx.doi.org/10.1016/j.ijid.2021.11.009
38. Watson OJ, Barnsley G, Toor J, Hogan AB, Winskill P, Ghani AC. Global
impact of the first year of COVID-19 vaccination: a mathematical modelling study. Lancet Infect Dis [Internet]. 2022;22:1293-302. http://dx.doi.org/10.1016/S1473-3099(22)00320-6
39. Zeng
B, Gao L, Zhou Q, Yu K, Sun F. Effectiveness of COÂVID-19
vaccines against SARS-CoV-2 variants of concern: a systematic review and
meta-analysis. BMC Med [Internet]. 2022;20:200. http://dx.doi.org/10.1186/s12916-022-02397-y
40. Macchia
A, Ferrante D, Angeleri P,
et al. Evaluation of a COVID-19 Vaccine Campaign and SARS-CoV-2 InfecÂtion and
Mortality Among Adults Aged 60 Years and Older in a Middle-Income Country. JAMA
Netw Open [Internet]. 2021;4:e2130800.
http://dx.doi.org/10.1001/jamanetworkopen.2021.30800
41. Rearte
A, Castelli JM, Rearte R,
et al. Effectiveness of rAd26-rAd5, ChAdOx1 nCoV-19, and BBIBP-CorV vaccines for risk of infection with SARS-CoV-2 and
death due to COVID-19 in people older than 60 years in Argentina: a
test-negative, case-control, and retrospective longitudinal study. Lancet [Internet]. 2022;399:1254-64.
http://dx.doi.org/10.1016/S0140-6736(22)00011-3
42. González S, Olszevicki S, Gaiano A, et al.
Effectiveness of BBIBP-CorV, BNT162b2 and mRNA-1273
vaccines against hospitalisations among children and
adolescents during the Omicron outbreak in Argentina: A retrospective cohort
study. The Lancet Regional Health-Americas [Internet].
2022;13:100316. https://www.sciencedirect.com/science/article/pii/S2667193X22001338
43. Rotshild
V, Hirsh-Raccah B, Miskin
I, Muszkat M, Matok I.
Comparing the clinical efficacy of COVID-19 vaccines: a systematic review and
network meta-analysis. Sci Rep [Internet]. 2021;11:22777. http://dx.doi.org/10.1038/s41598-021-02321-z
44. Ayoubkhani
D, Bermingham C, Pouwels KB, et al. Trajectory of long covid symptoms after covid-19 vacÂcination: community based
cohort study. BMJ
[Internet]. 2022;377:e069676.
http://dx.doi.org/10.1136/bmj-2021-069676
45.
Janssen C, Cachanado M, Ninove L, et al. ImmunogenicÂity
and reactogenicity of heterologous and homologous
mRNA-1273 and BNT162b2 vaccination: A multicenter non-inferiority randomized
trial. EClinicalMedicine [Internet]. 2022;48:101444. http://dx.doi.org/10.1016/j.eclinm.2022.101444
46. Khoury
DS, Cromer D, Reynaldi A, Schlub
TE, Wheatley AK, Juno JA, et al. Neutralizing antibody
levels are highly predictive of immune protection from symptomatic SARS-CoV-2
infection. Nat Med [Internet]. 2021;27:1205-11.
http://dx.doi.org/10.1038/s41591-021-01377-8
47. Bar-On YM, Goldberg Y, Mandel
M, et al. Protection of BNT162b2 Vaccine Booster against Covid-19 in Israel. N Engl J Med [Internet]. 2021;385:1393-400. http://dx.doi.org/10.1056/NEJMoa2114255
48. Magen
O, Waxman JG, Makov-Assif M, et al. Fourth Dose of
BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Setting. N Engl J Med [Internet]. 2022;386:1603-14.
http://dx.doi.org/10.1056/NEJMoa2201688
49. Wu N, Joyal-Desmarais
K, Ribeiro PA, et al. Long-term effectiveness of
COVID-19 vaccines against infections, hospitalisations,
and mortality in adults: findings from a rapid living systematic evidence
synthesis and meta-analysis up to December, 2022. Lancet Respir
Med [InÂternet]. 2023;11:439-52.
http://dx.doi.org/10.1016/S2213-2600(23)00015-2
50.
Salud actualiza las recomendaciones para la vacunaciĂłn de refuerzo contra
COVID-19 y fomenta su aplicaciĂłn para mantener una protecciĂłn adecuada
[Internet]. Argentina.gob.ar. 2023 [cited 2023 Jun 2]. https://www.argentina.gob.ar/noticias/salud-actualiza-las-recomendaciones-para-la-vacunacion-de-refuerzo-contra-covid-19-y
51. Chalkias
S, Harper C, Vrbicky K, Walsh SR, Essink
B, Brosz A, et al. A Bivalent
Omicron-Containing Booster Vaccine against Covid-19. N
Engl J Med [Internet]. 2022;387:1279-
91. http://dx.doi.org/10.1056/NEJMoa2208343
52. Office of the Commissioner.
Coronavirus (COVID-19) UpÂdate: FDA Authorizes Moderna,
Pfizer-BioNTech Bivalent COVID-19 Vaccines for Use as
a Booster Dose [Internet]. U.S. Food and Drug Administration.
FDA; [cited 2023 Jun 9].
https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-moderna-pfizer-biontech-bivalent-covid-19-vaccines-use
53. Collier AY, Miller J, Hachmann NP. Immunogenicity of BA.
5 Bivalent mRNA Vaccine Boosters. New
England Journal of … [Internet]. 2023;
https://www.nejm.org/doi/full/10.1056/NEJMc2213948
54. Link-Gelles
R, Ciesla AA, Fleming-Dutra KE, et al. EfÂfectiveness
of bivalent mRNA vaccines in preventing symptomatic SARS-CoV-2 infection -
Increasing CommuÂnity Access to testing program, United States, September-
November 2022. MMWR Morb Mortal Wkly Rep [Internet]. 2022;71:1526-30.
https://www.cdc.gov/mmwr/volumes/71/wr/mm7148e1.htm?s
55. Blankson
JN. Bivalent COVID-19 Vaccines: Can the Original Antigenic Sin Be Forgiven? J
Infect Dis [Internet]. 2023;227:1221-3.
http://dx.doi.org/10.1093/infdis/jiad073
56. Stein C, Nassereldine
H, Sorensen RJ, et al. Past SARS-CoV-2 infection protection against
re-infection: a systematic review and meta-analysis. Lancet
[Internet]. 2023;401:833- 42.
https://doi.org/10.1016/S0140-6736(22)02465-5
57. Kouhpayeh
H, Ansari H. Adverse events following COVÂID-19 vaccination: A systematic
review and meta-analysis. Int Immunopharmacol
[Internet]. 2022;109:108906.
http://dx.doi.org/10.1016/j.intimp.2022.108906
58. Hippisley-Cox
J, Patone M, Mei XW, et al. Risk of thromÂbocytopenia
and thromboembolism after covid-19 vaccination and SARS-CoV-2 positive testing:
self-controlled case series study. BMJ [Internet]. 2021;374:n1931.
http://dx.doi.org/10.1136/bmj.n1931
59. Kerr S, Joy M, Torabi F, et al. First dose ChAdOx1 and BNT162b2 °COVID-19
vaccinations and cerebral venous sinus thrombosis: A pooled self-controlled
case series study of 11.6 million individuals in England, Scotland, and Wales. PLoS Med
[Internet]. 2022;19:e1003927.
https://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.1003927
60. Cho JY, Kim KH, Lee N, et al.
COVID-19 vaccination-related myocarditis: a Korean nationwide study. Eur Heart J [Internet]. 2023 Jun 2;
http://dx.doi.org/10.1093/eurheartj/ehad339
61. Patone
M, Mei XW, Handunnetthi L, et al. Risks of myoÂcarditis,
pericarditis, and cardiac arrhythmias associated with COVID-19 vaccination or
SARS-CoV-2 infection. Nat Med [Internet]. 2022;28:410-22. http://dx.doi.org/10.1038/s41591-021-01630-0
62. Cherry JD. Epidemiological,
clinical, and laboratory aspects of pertussis in adults. Clin Infect Dis [Internet]. 1999;28
Suppl 2:S112-7. http://dx.doi.org/10.1086/515058
63. Edwards KM, Decker MD. Acellular
pertussis vacÂcines for infants. N Engl
J Med [Internet]. Mass MediÂcal Soc. 1996;334:391-2.
http://dx.doi.org/10.1056/NEJM199602083340609
64. Liang JL, Tiwari
T, Moro P, et al. Prevention of Pertussis, Tetanus, and Diphtheria with
Vaccines in the United States: Recommendations of the Advisory Committee on
ImmuniÂzation Practices (ACIP). MMWR Recomm Rep
[Internet]. 2018;67:1-44.
http://dx.doi.org/10.15585/mmwr.rr6702a1
65. Global Strategy for the
Diagnosis, Management and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. 2023 Report. GOLD; 2023. Report
No.: Version 1.3.
66. Hope-Simpson RE. The Nature
of Herpes Zoster: A Long Term Study and a New Hypothesis. Proc R Soc
Med [Internet]. 1965;58:9-20.
https://www.ncbi.nlm.nih.gov/pubmed/14267505
67. Kim JH, DĂaz-Decaro
J, Jiang N, Hwang SJ, Choo EJ, Co M, et al. The adjuvanted recombinant zoster vaccine is efficacious and
safe in Asian adults ≥ 50 years of age: a
sub-cohort analysis of the ZOE-50 and ZOE-70 randomized trials. Hum Vaccin Immunother [Internet].
2021;17:2050- 7.
http://dx.doi.org/10.1080/21645515.2020.1859321
68. Johnson BH, Palmer L, Gatwood J, Lenhart G, Kawai K,
Acosta CJ. Annual incidence rates of herpes zoster among an immunocompetent
population in the United States. BMC Infect Dis [Internet]. 2015;15:502. http://dx.doi.org/10.1186/s12879-015-1262-8
69. Pinchinat
S, Cebrián-Cuenca AM, Bricout H, Johnson RW. Similar herpes zoster incidence
across Europe: results from a systematic literature review. BMC Infect Dis
[Internet]. 2013;13:170.
http://dx.doi.org/10.1186/1471-2334-13-170
70. Harpaz
R, Ortega-Sanchez IR, Seward JF, Advisory ComÂmittee on Immunization Practices
(ACIP) Centers for Disease Control and Prevention (CDC). Prevention of herpes
zoster: recommendations of the Advisory CommitÂtee on Immunization Practices
(ACIP). MMWR Recomm Rep [Internet]. 2008;57(RR-5):1-30; quiz CE2–4.
https://www.ncbi.nlm.nih.gov/pubmed/18528318
71. Cunningham AL, Lal H, Kovac M, et al. Efficacy
of the Herpes Zoster Subunit Vaccine in Adults 70 Years of Age or Older. N Engl J Med [Internet]. 2016;375:1019-32. http://dx.doi.org/10.1056/NEJMoa1603800
72. Muñoz-Quiles
C, LĂłpez-Lacort M, DĂez-Domingo
J, Orrico- Sánchez A. Herpes zoster risk and burden
of disease in immunocompromised populations: a
population-based study using health system integrated databases, 2009- 2014.
BMC Infect Dis [Internet]. 2020;20:905.
http://dx.doi.org/10.1186/s12879-020-05648-6
73. Heineman TC, Cunningham A, Levin M. Understanding the
immunology of Shingrix, a recombinant glycoprotein E adjuÂvanted herpes zoster vaccine. Curr Opin Immunol
[Internet]. 2019;59:42-8.
http://dx.doi.org/10.1016/j.coi.2019.02.009
74. Gershon
AA, Gershon MD, Breuer J, Levin MJ, Oaklander AL, Griffiths PD. Advances in the understanding
of the pathogenesis and epidemiology of herpes zoster. J Clin
Virol [Internet]. 2010;48 Suppl 1(Suppl 1):S2-7.
http://dx.doi.org/10.1016/S1386-6532(10)70002-0
75. Sampathkumar
P, Drage LA, Martin DP. Herpes
zoster (shingles) and postherpetic neuralgia. Mayo Clin Proc [Internet]. 2009;84:274-80. http://dx.doi.org/10.1016/S0025-6196(11)61146-4
76.
Kawai K, Gebremeskel BG,
Acosta CJ. Systematic review of incidence and complications of
herpes zoster: towards a global perspective. BMJ Open
[Internet]. 2014;4:e004833.
http://dx.doi.org/10.1136/bmjopen-2014-004833
77. Lal
H, Cunningham AL, Godeaux O, Chlibek
R, DĂez- Domingo J, Hwang SJ, et al. Efficacy of an adjuvanted herpes zoster subunit vaccine in older adults. N Engl J Med [Internet]. 2015;372:2087-96. http://dx.doi.org/10.1056/NEJMoa1501184
78. Santibanez
TA, Zimmerman RK, Nowalk MP, Jewell IK, Bardella IJ. Physician attitudes and beliefs associated
with patient pneumococcal polysaccharide vaccination status. Ann Fam Med [Internet]. 2004;2:41-8. http://dx.doi.org/10.1370/afm.53
79. Branche
AR, Saiman L, Walsh EE, Falsey
AR, Jia H, Barrett A, et al. Change in functional
status associated with respiratory syncytial virus infection in hospitalized
older adults. Influenza Other Respi
Viruses [Internet]. 2022;16:1151-60.
http://dx.doi.org/10.1111/irv.13043
80.
DirecciĂłn Nacional de EpidemiologĂa y Análisis de la SituÂaciĂłn de Salud.
BoletĂn Integrado de Vigilancia. Ministerio de Salud de Argentina; 2019. Report No.: 477.
81. CDC. Learn about Respiratory
Syncytial Virus Infection (RSV) [Internet]. Centers for
Disease Control and PrevenÂtion. 2023 [cited 2023 Jun 10].
https://www.cdc.gov/rsv/index.html
82. Papi
A, Ison MG, Langley JM, et al. Respiratory Syncytial
Virus Prefusion F Protein Vaccine in Older Adults. N Engl J Med [Internet]. 2023;388:595-608. http://dx.doi.org/10.1056/NEJMoa2209604
83. Centers for Disease Control
and Prevention (CDC), AdÂvisory Committee on Immunization Practices. Updated recommendations for prevention of invasive pneumococcal
disease among adults using the 23-valent pneumococcal polysaccharide vaccine
(PPSV23). MMWR Morb Mortal Wkly Rep [Internet]. 2010;59:1102-6.
https://www.ncbi.nlm.nih.gov/pubmed/20814406
84. Centers for Disease and
Prevention. Healthy People 2023 [Internet]. [cited 2023 Jun 9].
https://www.cdc.gov/nchs/healthy_people/hp2030/hp2030.htm
85. Boikos
C, Quach C. Risk of invasive pneumococcal disÂease in
children and adults with asthma: a systematic review. Vaccine
[Internet]. 2013;31:4820-6.
http://dx.doi.org/10.1016/j.vaccine.2013.07.079
86. Vila-CĂłrcoles
A, Ochoa-Gondar O. [Pneumococcal disease in adults: Risk levels and vaccine
recommendations]. Aten
Primaria [Internet]. 2017;49:111–7.
http://dx.doi.org/10.1016/j.aprim.2016.06.007
87.
Sánchez CA. GEMA 5.0: guĂa española para el manejo del asma [Internet]. 2020.
https://books.google.com/books/about/GEMA_5_0.html?hl=&id=emt_zwEACAAJ
88.
Adamuz J, Viasus D,
JimĂ©nez-MartĂnez E, et al. Incidence, timing and
risk factors associated with 1-year mortality after hospitalization for
community-acquired pneumoÂnia. J Infect [Internet]. 2014;68:534-41. http://dx.doi.org/10.1016/j.jinf.2014.02.006
89.
DirecciĂłn Nacional de Control de Enfermedades InmunoÂprevenibles.
Manual del vacunador. Lineamientos TĂ©cniÂcos. Ministerio de Salud; 2022.
90.
Estrategia Nacional de PrevenciĂłn y Control de EnfermeÂdades No Transmisibles.
GuĂa de Práctica ClĂnica Nacional de DiagnĂłstico y Tratamiento de la Enfermedad
Pulmonar Obstructiva CrĂłnica. Ministerio de Salud de Argentina; 2016.
91.
Miravitlles M, Calle M, Molina J, et al.
ActualizaciĂłn 2021 de la GuĂa Española de la EPOC (GesEPOC).
TrataÂmiento farmacolĂłgico de la EPOC estable. Archivos de BronconeumologĂa
[Internet]. 2022;58:69-81.
https://www.sciencedirect.com/science/article/pii/S0300289621001034
92. Kopsaftis Z, Wood-Baker R, Poole P. Influenza vaccine for
chronic obstructive pulmonary disease (COPD). Cochrane Database Syst Rev [Internet]. 2018;6:CD002733.
http://dx.doi.org/10.1002/14651858.CD002733.pub3
93. Wongsurakiat
P, Maranetra KN, Wasi C, Kositanont U, Dejsomritrutai W, Charoenratanakul S. Acute respiratory illness in patients
with COPD and the effectiveness of inÂfluenza vaccination: a randomized
controlled study. Chest [Internet]. 2004;1252011-20. http://dx.doi.org/10.1378/chest.125.6.2011
94. MartĂnez-Baz
I, Casado I, Navascués A,
et al. Chronic obÂstructive pulmonary disease and influenza vaccination efÂfect
in preventing outpatient and inpatient influenza cases. Sci
Rep [Internet]. 2022;12:4862.
http://dx.doi.org/10.1038/s41598-022-08952-0
95. Huang CL, Nguyen PA, Kuo PL, Iqbal U, Hsu YHE, Jian WS. Influenza vaccination and
reduction in risk of ischemic heart disease among chronic obstructive pulmonary
elderly. Comput Methods Programs Biomed
[Internet]. 2013;111:507-11.
http://dx.doi.org/10.1016/j.cmpb.2013.05.006
96. Sehatzadeh
S. Influenza and pneumococcal vaccinations for patients with chronic
obstructive pulmonary disease (COPD): an evidence-based review. Ont Health Technol Assess Ser [Internet]. 2012;12:1-64.
https://www.ncbi.nlm.nih.gov/pubmed/23074431
97. Walters JA, Tang JNQ, Poole
P, Wood-Baker R. PneuÂmococcal vaccines for preventing pneumonia in chronÂic
obstructive pulmonary disease. Cochrane Database Syst
Rev [Internet]. 2017;1:CD001390.
http://dx.doi.org/10.1002/14651858.CD001390.pub4
98. Walters JA, Smith S, Poole P,
Granger RH, Wood-Baker R. Injectable vaccines for preventing pneumococcal infection
in patients with chronic obstructive pulmoÂnary disease. Cochrane Database Syst Rev [Internet]. 2010;(11):CD001390.
http://dx.doi.org/10.1002/14651858.CD001390.pub3
99. Adler AJ, Eames KTD, Funk S,
Edmunds WJ. Incidence and risk factors for influenza-like-illness in the UK:
online surveillance using Flusurvey. BMC Infect Dis
[Internet]. 2014 May 1;14:232.
http://dx.doi.org/10.1186/1471-2334-14-232
100. Matanock
A, Lee G, Gierke R, Kobayashi M, Leidner
A, Pilishvili T. Use of 13-Valent Pneumococcal Conjugate
VacÂcine and 23-Valent Pneumococcal Polysaccharide Vaccine Among Adults Aged ≥65
Years: Updated Recommendations of the Advisory Committee on Immunization
Practices. MMWR Morb Mortal Wkly Rep [Internet]. 2019;68:1069-
75. http://dx.doi.org/10.15585/mmwr.mm6846a5
101. Kobayashi M, Farrar JL, Gierke R, Britton A, Childs L, Leidner
AJ, et al. Use of 15-Valent Pneumococcal Conjugate Vaccine and 20-Valent
Pneumococcal Conjugate Vaccine Among U.S. Adults: Updated Recommendations of
the Advisory Committee on Immunization Practices - United States, 2022. MMWR Morb Mortal Wkly
Rep [Internet]. 2022;71:109-17.
http://dx.doi.org/10.15585/mmwr.mm7104a1
102. O’Grady KAF, Chang AB, Grimwood K. Vaccines for chilÂdren and adults with chronic
lung disease: efficacy against acute exacerbations. Expert
Rev Respir Med [Internet]. 2014;8:43-55. http://dx.doi.org/10.1586/17476348.2014.8 52960
103. O’Grady KAF, Cripps AW, Grimwood K. Paediatric and adult
bronchiectasis: Vaccination in prevention and manÂagement. Respirology [Internet]. 2019;24:107-14. http://dx.doi.org/10.1111/resp.13446