Autor : De Vito, Eduardo L.1,2, Arce, Santiago C.1, Monteiro, Sergio G.1
1Instituto de Investigaciones MĂ©dicas Alfredo Lanari, Facultad de Medicina, Universidad de Buenos Aires, Buenos Aires, Argentina. 2Centro del Parque, Cuidados Respiratorios, Buenos Aires, Argentina.
https://doi.org/10.56538/ramr.KDJX9656
Correspondencia : Eduardo Luis De Vito, E-mail: eldevito@gmail.com
RESUMEN
No
todos sentimos lo mismo ante un estĂmulo fĂsico, cada uno expresa una sensaciĂłn
con diferentes palabras, no todos describimos de igual forma las sensaciones
respiÂratorias y, por quĂ© no decirlo, no todos los profesionales entienden lo
que el paciente les relata. La psicofĂsica de la disnea (las relaciones
cuantitativas entre un estĂmulo respiratorio y una sensaciĂłn), los descriptores
para referirse a la falta de aire (el lenguaje de la disnea) pueden ayudar a
romper las barreras comunicacionales entre pacientes, familia y personal de
salud. Los datos generales apoyan una red cortical-lĂmbica para la percepciĂłn
de la disnea. Hay acuerdo en que la corteza insular es un elemento central esencial
para el circuito neuronal, mientras que la corteza cingulada
anterior y la corteza prefrontal dorsolateral
se cree que modulan la magnitud de la percepciĂłn de disnea y su alivio. La
disnea como un fenĂłmeno del sistema nervioso central y con dimensiones tanto
sensoriales como afectivas, esto ha sido confirmado en estudios de neuroimágenes. Se ha establecido firmemente que la disnea
es una experiencia comÂpleja de la mente y el cuerpo, que comprende diferentes
sensaciones que solo pueden ser percibidas por el individuo. Los componentes
afectivos impulsan los sentimientos acompañantes de angustia, miedo y ansiedad,
y es el cerebro, no los pulmones, el que genera estos fenĂłmenos.
Palabras
clave: Disnea,
FisiologĂa, FisiopatologĂa, PsicofĂsica, Descriptores
ABSTRACT
When confronted with a physical
stimulus, not everyone feels the same way; each one expresses a sensation with
different words; not all of us describe respiratory sensations in the same way;
and, why not say it, not all professionals understand what the patient tells
them. The psychophysics of dyspnea (the quantitative relationships between a reÂspiratory
stimulus and a sensation) and descriptors for shortness of breath (the dyspnea
language) can aid in breaking down communication barriers between patients,
families, and health care personnel. The insular
cortex is widely agreed to be an important cenÂtral component of neural
circuitry, while the anterior cingulate cortex and dorsolateral prefrontal
cortex are thought to modulate the magnitude of dyspnea perception and its
relief. Dyspnea is a central nervous system phenomenon, and neuroimaging
studies have confirmed this with both sensory and affective dimensions. Dyspnea
is a complex mind-body experience that consists of different sensations that
can only be perceived by the individual. The accompanying feelings of distress,
fear, and anxiety are driven by affective components, which are generated by
the brain rather than the lungs.
Key words: Dyspnea, Breathlessness, Physiology, Pathophysiology, Psychophysics,
Descriptors
Recibido: 03/12/2022
Aceptado: 16/01/2024
LEYES PSICOFĂŤSICAS EN
GENERAL
NingĂşn
relato histĂłrico de la disnea estarĂa comÂpleto sin mencionar el papel de la psicofĂsica.
El análisis minucioso de este tema está fuera de los objetivos de este
artĂculo. Se pueden consultar las excelentes publicaciones de Mahler.1, 2 Las leyes
psicofĂsicas son un conjunto de expresiones matemáticas que intentan determinar
relaciones cuantitativas entre el estĂmulo o parámetros de entrada y la
sensación o parámetros de salida (respuestas de percepción).
El
estudio de las sensaciones no respiratorias data de mediados del siglo XIX. El
mĂ©dico y fĂsico alemán Hermann von Helmholtz acuñó el tĂ©rmino “psicofĂsica” y estableciĂł una
relaciĂłn precisa y no lineal entre la magnitud de los estĂmulos fĂsicos
y la intensidad percibida. Helmholtz allanĂł el caÂmino
para el desarrollo de las “leyes psicofĂsicas”. Los autores insoslayables del
siglo XIX son Weber y Fechner, mientras que Stevens y
Borg son los representantes de la segunda mitad del
siglo XX y a ellos se atribuye la aplicaciĂłn de las medidas psicofĂsicas a las
sensaciones respiratorias.
En
1846 Weber reportĂł que la diferencia mĂnima perceptible (just noticeable difference) en intensiÂdad entre dos estĂmulos es una
fracciĂłn constante de la intensidad del primer estĂmulo:
Diferencia mĂnima = delta
estĂmulo (es una
perceptible EstĂmulo constante)
Es
decir, cuanto mayor sea el estĂmulo de base (por ejemplo, un sonido), mayor
deberá ser el camÂbio en la magnitud del estĂmulo para detectarlo (no se cumple
para estĂmulos extremos).1
A
finales de la década de la década de 1950, Stevens pudo estudiar las respuestas
para diverÂsos modos sensoriales (luz, sonido, gusto, olfato, tacto, fuerza
muscular, movimiento).2-4 Él expresó la
relaciĂłn entre la intensidad del estĂmulo y la magnitud de la sensaciĂłn con su
ley psicofĂsica (o ley de la potencia, power
law):
S = c Ek
donde S es la magnitud de la
sensaciĂłn; c, una constante arbitraria; E, es la intensidad del
estĂmuÂlo; y k, el exponente que depende de la modalidad sensorial y de
las condiciones ambientales. Es muy relevante el exponente k que provee
informaciĂłn sobre cĂłmo se procesa sensorialmente el estĂmulo.
–
Cuando k = 1 (apreciaciĂłn visual de la longitud de una lĂnea recta), la
magnitud psicolĂłgica corresponde directamente a cambios en el estĂÂmulo.
–
Cuando es mayor que 1 (shock elĂ©ctrico, temÂperatura) pequeños cambios
en la magnitud del estĂmulo se expanden en un amplio rango de magnitud
psicolĂłgica.
–
Cuando es menor que 1 (luz, sonido) amplios ranÂgo de magnitud de estĂmulo son
juzgados como pequeños en cuanto a magnitud psicológica.
PSICOFĂŤSICA DE LA
DISNEA
Bakers y Tenney en
1970 fueron los primeros en aplicar la Ley de Stevens a las variables respiraÂtorias.5 De hecho, en
el aparato respiratorio, la exÂperiencia sensorial es más compleja, se estudia
en términos de relaciones entre la presión inspiratoria y la sensación
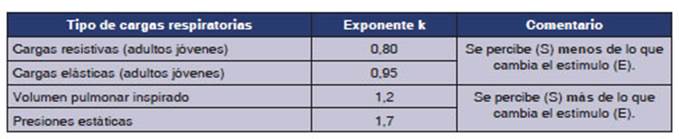
resultante. No todos los estĂmulos respiratorios tienen el mismo exponente.
La
ley de Weber tendrĂa importantes implicaÂciones para el estudio de pacientes
con mecánica respiratoria anormal, en los cuales la resistencia de la vĂa aĂ©rea
o la elastancia pulmonar suelen estar aumentadas. Los
estudios de la Ă©poca establecieron lo siguiente:
–
Los sujetos normales mayores de 60 años perÂciben menos las cargas elásticas y
resistivas comparados con sujetos normales menores de 30 años (tienen
exponentes k menores).
–
Los pacientes con EPOC perciben menos las cargas resistivas (tienen exponentes
k menores).
–
Sujetos normales y asmáticos perciben igual (tienen el mismo exponente k), excepto
en el grupo con asma casi fatal (tienen exponente k menores, perciben menos).
Leyes psicofĂsicas y
la escala de Borg
El
resultado de la aplicación de estas leyes fue la concepción, en el año 1982, de
la bien conocida escala de Borg y otras similares.1-4 La escala de Borg (inicialmente creada para la percepciĂłn de disnea
durante el ejercicio) pudo conciliar una magnitud sensorial absoluta (0 a 10)
con una seÂmántica cuantitativa (leve, moderada, grave, etc.) y con algunas
modificaciones. Es hoy ampliamente utilizada para cuantificar la disnea y las
molestias musculares durante la actividad fĂsica. Además, entre los años 1981 y
1989, fue posible llegar a dos conclusiones de interés:5, 6
–
La intensidad de la molestia es proporcional a la desviaciĂłn del patrĂłn
ventilatorio espontáneo. Esto puso en relieve los exquisitos mecanismos que
operan para minimizar la disnea en situaÂciones fisiolĂłgicas y patolĂłgicas.
–
La adaptaciĂłn temporal, segĂşn la cual la magÂnitud sensorial declina de acuerdo
a una simple funciĂłn exponencial con el tiempo (y segĂşn la magnitud del
estĂmulo o carga respiratoria), permitiĂł explicar porque con estĂmulos de alta
intensidad o sobre estimulaciĂłn crĂłnica, ciertos pacientes pueden estar
llamativamente asintoÂmáticos.
No
obstante, cabe mencionar que, con una mayor comprensiĂłn de la naturaleza
multidimenÂsional de la disnea, se han desarrollado nuevas escalas precisas que
evalĂşan los componentes sensoriales y afectivos de la sensaciĂłn, y su uso
deberĂa formar parte de la atenciĂłn de rutina ciertos pacientes.7
El lenguaje de la
disnea. Descriptores
Nuestra
capacidad para conceptualizar y comuniÂcar una idea depende de nuestro Ă©xito en
dar vida a la idea a través del lenguaje y, a su vez, el médico debe saber
decodificar ese lenguaje.
Cuando
un médico se enfrenta a un paciente que refiere dolor torácico, suele hacerle
una serie de preguntas sobre la intensidad y calidad de la sensaciĂłn dolorosa.
ÂżEn una escala de 0-10 que puntaje le pondrĂa?, ÂżquĂ© caracterĂsticas tiene?,
ÂżvarĂa con la respiraciĂłn, con la tos?, Âżirradia a otra parte del cuerpo? Los
textos tradicionales utilizados por los estudiantes de las escuelas de medicina
no discuten los aspectos cualitativos de la disnea quizá porque suele ser
considerada una Ăşnica sensaciĂłn.
El
concepto de “calidad” de la disnea estaba presente desde los tiempos de Comroe, Campbell y Guz, pero
recién en 1990 comenzó la tarea de desarrollar un lenguaje de la disnea que
permitirĂa a los pacientes y mĂ©dicos comunicar lo inherente a las molestias
respiratorias. De hecho, la definiciĂłn actual de disnea contempla sensaciones
cualitativamente diferentes.8
Los
intentos de asociar determinadas condiÂciones o enfermedades con sensaciones cualitatiÂvamente
especĂficas no arrojaron los resultados deseados. No es posible asegurar con
razonable certeza que un determinado tipo de sensaciĂłn corresponda a una
enfermedad al punto que pueÂda ser de orientaciĂłn diagnĂłstica. Hay mĂşltiples
mecanismos fisiolĂłgicos que subyacen a la disnea en diferentes estados de
enfermedad, asĂ como la presencia de mĂşltiples sensaciones que pueden coexistir
dentro de un paciente determinado.
El
lenguaje de la disnea se basa en cĂłmo se la comunica, para ello, el espectro de
los descriptores es amplio.9-11 Algunos de
ellos son referidos con más frecuencia que otros y, si bien permiten entender
la angustia que generan y el impacto que produce (incluso
sensaciĂłn de muerte), de ninguna manera pueden ser considerados como una guĂa
clĂnica que oriente a las causas de la disnea. Los descriptores han sido
desarrollados por Simon,9-11
pero no disponemos de una validación española de estos.
La atenciĂłn al uso de descriptores verbales de disnea puede ayudar
al clĂnico a evitar subestimar la gravedad de la limitaciĂłn del flujo de aire
cuando no es posible realizar mediciones objetivas de la funciĂłn pulmonar. No
obstante, no se puede ignoÂrar cierta superposiciĂłn, aunque las tendencias
parecen consistentes:
– El descriptor “mayor trabajo de respiración” se asocia con EPOC,
asma moderada a grave, miopatĂa y fibrosis pulmonar.
– Los pacientes con EPOC e hiperinflaciĂłn diÂnámica a veces se
quejan de una sensación de “respiraciones insatisfactorias/entrecortadas/
incompletas” o una sensación de que “no pueden respirar profundamente”.
– Una “sensaciĂłn de respiraciĂłn rápida y suÂperficial” puede
corresponder a enfermedad pulmonar intersticial o disminuciĂłn de la disÂtensibilidad de la pared torácica.
– La insuficiencia cardĂaca tambiĂ©n se asocia con una sensaciĂłn de
“asfixia/ahogo”.
– Una sensaciĂłn de “respiraciĂłn pesada” es tĂpica del descondicionamiento.
Las barreras comunicacionales para entender el lenguaje de la
disnea son mĂşltiples (Tabla 2). Mediante el desarrollo de cuestionarios de
disnea, los mĂ©dicos y sus pacientes tienen una mayor proÂbabilidad de
comunicarse con precisiĂłn sobre los sĂntomas respiratorios, y los mecanismos.

Es importante recordar que el idioma, el género, el origen étnico
y la cultura de un individuo pueden influir en la redacciĂłn utilizada para
describir la disnea.11
PROCESAMIENTO
CENTRAL DE LA DISNEA
Sustrato
cortical para la percepciĂłn de disnea
A finales del siglo XX, se sabĂa relativamente poco sobre las vĂas
ascendentes responsables de la disnea. La disnea implica varios tipos distintos
de receptores y sensaciones y era razonable esperar que los mecanismos
aferentes responsables de ella eran probablemente más complicados que para el
dolor. Las lĂneas tendientes a identificar las áreas cerebrales para la
percepciĂłn de disnea se pueden agrupar en dos categorĂas:
– Estudios neurofisiológicos mediante potenciales evocados.12-14
– Estudios mediante imágenes (tomografĂa por emisiĂłn de positrones
[PET], resonancia magnĂ©Âtica funcional [FMRI] con tĂ©cnica dependiente del nivel
de oxigenaciĂłn sanguĂnea (BOLD, blood oxygenation level dependent,).15-17
Estudios
neurofisiológicos-aferencias frénicas
El primer estudio para establecer un vĂnculo neuÂrofisiolĂłgico
entre los aferentes frénicos y la corteza somatosensorial
fue el de Frankstein.12 Hasta los años 80, existĂa una creencia
arraigada segĂşn la cual los reflejos mediados por aferentes en el diafragma
eran irrelevantes o ausentes. Esta concepciĂłn coÂmenzĂł a cambiar cuando se
descubrió que aproximadamente el 30-45 % las fibras del nervio frénico son
aferentes sensoriales. Es indudable que a los centros superiores les interesa
el tipo de actividad y el estado contráctil del diafragma. Las aferencias
frĂ©nicas contribuyen a la somatosensaciĂłn diafragÂmática,
a la percepciĂłn consciente de la respiraciĂłn y las respuestas a la carga
respiratoria.18 La Figura 1 muestra esas proyecciones.
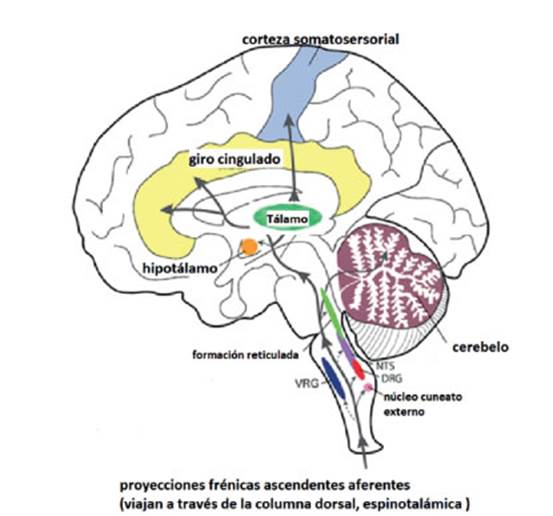
El nervio frĂ©nico contiene fibras de varios tiÂpos de receptores
sensoriales: husos musculares, Ăłrganos tendinosos, ergorreceptores
y nociceptoÂres. El flujo diafragmático sensorial a
la médula espinal está organizado somatotópicamente.19-21 Las
proyecciones supraespinales, troncoencefáliÂcas,
cerebelosas y talámicas
alcanzan áreas con impacto directo e indirecto sobre el control motor
respiratorio y modulan el impulso.21 Las proyeccioÂnes supraespinales de neuronas aferentes frĂ©nicas han sido
confirmadas en mĂşltiples investigaciones. AsĂ como el destino potencial de las
vĂas desde los receptores de diafragma.21 VRG, grupo respiratorio
ventral; NTS, nĂşcleo del tracto solitario; DRG, grupo respiratorio dorsal.
Aferencias
frénicas, estados emocionales y dolor
El hecho de que las aferencias frénicas también se proyectan hacia
el sistema lĂmbico en los humaÂnos sugiere un posible vĂnculo entre las
aferentes sensoriales del diafragma y el estado emocional: las respuestas
evocadas corticalmente a las ocluÂsiones inspiratorias breves están fuertemente
moduladas por el estado afectivo en los humanos. Las aferencias frénicas también
pueden estar involucradas en el dolor de hombro o cuello. Esta respuesta
probablemente refleja la activación de aferentes frénicos del grupo III-IV que
convergen con el tracto espinotalámico en la médula
espinal cervical alta.21
En resumen, los datos de los animales confirÂman que los
aferentes sensoriales del diafragma activan las neuronas en la corteza somatosensorial, y los datos en humanos son totalmente
consistentes con estas observaciones. Además de la modulación del patrón
respiratorio, la información transmitida a través de los aferentes frénicos
contribuye a la somatosensaciĂłn del diafragma y a la
percepciĂłn consciente de la respiraciĂłn.
Queda mucho por aprender sobre el posible rol de las aferencias
frénicas en la activación o modulación de la expresión de la neuroplasticidad respiratoria, particularmente en el
contexto de la rehabilitaciĂłn tras una lesiĂłn neurolĂłgica o una enfermedad
neuromuscular.
Estudios
mediante imágenes funcionales
Si bien a principios de los años 90, se postulaba que las
proyecciones rostrales de las neuronas motoras respiratorias del tallo cerebral
al cerebro medio y el tálamo podrĂan representar la vĂa de descarga corolaria central a la corteza sensorial,15
hasta el año 1994 la región de la corteza cerebral que procesa la información
relacionada con la disnea permanecĂa sin identificar.
Un estudio con tomografĂa por emisiĂłn de poÂsitrones (PET) sobre
la activaciĂłn del comando motor respiratorio durante la respiraciĂłn con CO2
proporcionĂł el primer indicio de que las áreas lĂmÂbicas podrĂan estar
involucradas en la percepciĂłn de disnea.22 Fue posible identificar
la activación neuronal en el tallo cerebral superior, mesencéfalo, hipotálamo,
tálamo, hipocampo y parahipocampo, circunvolución
fusiforme, área cingulada, Ănsula (considerado el
quinto lĂłbulo cerebral), corteza frontal, corteza temporo-occipital
y corteza parieÂtal. Esta activaciĂłn se considerĂł relevante en las respuestas
respiratorias sensoriales y motoras a la hipercapnia en personas despiertas.22,
23 La hiperÂcapnia per se produce disnea, independientemente del
aumento de la ventilaciĂłn que el CO2 produce (Figura 2).24
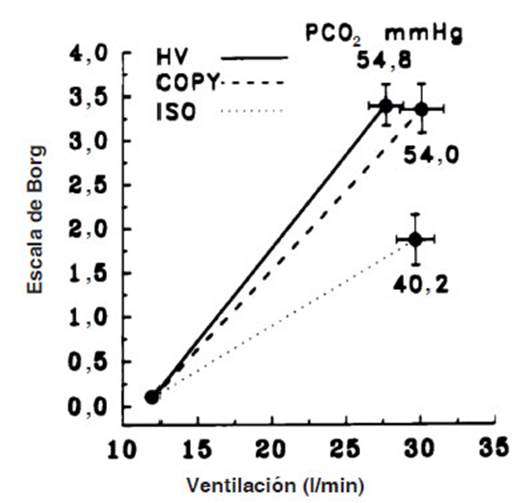
Para iguales niveles de hiperventilaciĂłn (HV), durante hipercapnia
(54,8 mmHg) la sensaciĂłn de disnea fue mayor que
durante isocapnia (ISO, 40,2 mmHg).
En este grupo de voluntarios sanos, el CO2 produjo disnea
independiente del aumento concomitante de la ventilaciĂłn.24
En lĂnea con estos hallazgos, Karleyto y
cols. encontraron que los lugares lĂmbicos y paralĂmbiÂcos activados por CO2 se encontraban
en la Ănsula anterior, opĂ©rculo, cerebelo, amĂgdala, tálamo y ganglios basales.
Algunos elementos frontoparietaÂles relacionados con
la atenciĂłn tambiĂ©n fueron acÂtivados.25 Las variables respiratorias
que tuvieron representación en estas áreas fueron hipercapnia, variaciones del Vt, cargas resistivas inspiratorias y espiratorias,
variaciones del Vt bajo asistencia ventilatoria
mecánica.16 Las imágenes cerebrales son incapaces de distinguir
entre las estructuras implicadas en el procesamiento afectivo y discrimiÂnatorio
y las respuestas conductuales motoras.26, 27
En resumen, los estudios sugirieron que la Ănsula es
esencial para la percepciĂłn de la disnea, aunque los datos actuales sugieren
que la Ănsula actĂşa en concierto con una red neuronal notableÂmente extensa y
compleja.
Componentes
sensoriales y afectivos
Los estudios pivote de entre los años 1995 a 2000 han proporcionado
evidencia convincente de que la intensidad sensorial y lo desagradable del
dolor son dimensiones diferentes. Incluso parecen estar supeditadas a vĂas
neurales separadas.28-30 En lĂnea con estos hallazgos, se ha propuesto un
modelo multidimensional de disnea con dos componentes: sensorial (es
decir, intensidad y calidad) y afectivo (evaluativo, desagradable).15,
16, 30 Davenport y Reep describieron las dos
principales vĂas sugeridas para procesar la sensaciĂłn respiratoria en la
corteza sensorial.31
1)
Se cree que los aspectos sensoriales (intenÂsidad y calidad) se originan
predominanteÂmente en aferentes ubicados en los mĂşsculos respiratorios (vĂa
aferencias frénicas y otras), se transmiten al tronco encefálico y se proyectan
hacia el área ventral del tálamo, desde donde las proyecciones talamocorticales ascienden a la corteza somatosensorial
primaria (áreas 3, 1 y 2 de Brodmann) y secundaria
(áreas 5 y 7 de Brodmann).16, 26, 30
2)
Los componentes afectivos (evaluativos desagradables) parecen ir por
otra vĂa. La informaciĂłn, principalmente aferentes vagales
de los pulmones y las vĂas respiratorias, se proyectan hacia el tronco
cerebral. Las proyecciones del tronco cerebral ascienden a la amĂgdala y al
área dorsal medial del tálamo y más allá de la Ănsula y la corteza cingulada e insular. Estas estructuras son parte del
sistema lĂmbico, que forman el borde interno de la corteza y contiene
interconexiones ricas entre la corteza cerebral, el tálamo y el tallo cerebral.
El sistema lĂmbico tambiĂ©n se considera importante con recomÂpensa, miedo,
hambre, sed y excitación sexual. Se cree que el tálamo y el hipocampo son áreas
neuronales crĂticas para la entrada sensorial respiratoria a la corteza
cerebral.16, 30
ÂżCĂłmo es que la
Ănsula da lugar a la percepciĂłn de disnea?
Si
bien existe evidencia creciente que sugiere que la corteza insular actĂşa como
un centro de interocepciĂłn y juega un papel
fundamental en la toma de conciencia de sentimientos subjetivos y no
simplemente un papel en el procesamiento de la percepciĂłn de desagrado, cabe
preguntarse cĂłmo es que la Ănsula da lugar a la percepciĂłn de disnea.32
Se
ha sugerido que el aumento de las descargas corolarias
desde el comando motor medular del tronco del encéfalo a los músculos
respiratorios pueden activar la Ănsula, presumiblemente incluso sin retroalimentaciĂłn
aferente perifĂ©rica de los meÂcanorreceptores
respiratorios. Además, aunque no está claro si el dolor y la disnea son
procesados por las mismas estructuras corticales o simplemente por estructuras
corticales vecinas, es evidente que la corteza insular juega un papel
importante en la percepciĂłn de ambas sensaciones.
Lecciones de
situaciones clĂnicas concretas
Como
se comentó, a fines de la primera década del siglo XXI, se comenzó a sugerir la
multidimenÂsionalidad similar en la
percepciĂłn del dolor y la disnea e incluye componentes sensoriales (es decir,
intensidad y calidad) y componentes afectivos. Este enfoque tiene implicaciones
clĂnicas.30-32
1)
Una alta sensibilidad parece favorable porque permite la detecciĂłn temprana del
deterioro de la función pulmonar y el alivio rápido con medicación.
2)
Un grado moderado de ansiedad relacionada con el asma bronquial es adaptativa
porque puede estar asociada con una mejor percepciĂłn de la broncoconstricciĂłn.
3)
Por otro lado, la ausencia de ansiedad puede llevar a indiferencia y descuido
de los sĂntomas.33
4)
Una percepciĂłn exagerada de la disnea, que puede conducir a un uso excesivo de
los recursos médicos, puede significar una respuesta excesiva en la dimensión
afectiva.
5)
La dimensiĂłn afectiva de la disnea (desagrado, respuesta emocional) parece no
depender estricÂtamente de la intensidad de la disnea.
Davenport
y cols. utilizaron la metodologĂa de potenciales
evocados relacionados con la respiÂraciĂłn en un grupo de niños asmáticos con
una historia de asma casi fatal.13 Encontraron una ausencia de
componente evocado en 6/11 niños después de la oclusión respiratoria (es decir,
la señal sensorial disneica no estaba activando la corteza somatosensorial).
Estos datos sugieren la presencia de un dĂ©ficit especĂfico en el asma casi
fatal en el procesamiento cortical de la informaciĂłn de carga respiratoria. No
es posible aĂşn dilucidar si los pacientes con percepciĂłn disminuida de disnea tienen
un dĂ©ficit especĂfico en los aspectos afectivos más que en los sensoriales de
su procesamiento perceptivo.
CONCLUSIONES
Una
diferenciaciĂłn entre los componentes senÂsoriales y afectivos de la disnea
puede ser de particular importancia en mejorar la precisiĂłn de la percepciĂłn de
los sĂntomas. Los estudios de neuroimágenes han
arrojado luz sobre las redes cerebrales involucradas en la percepciĂłn de los
componentes sensoriales y afectivos de la disnea. Queda por dilucidar si esto
puede contribuir al desarrollo de estrategias terapéuticas más efectivas para
pacientes con disnea.
NEUROBIOLOGĂŤA DE LA
DISNEA, OPIOIDES ENDĂ“GENOS Y EXĂ“GENOS
En
1985, Santiago y Edelman postularon que los opioides
endĂłgenos podrĂan ser elaborados como un mecanismo de protecciĂłn para aliviar
la dificulÂtad respiratoria.34 En 2009, O´Donnell
propuso un modelo neurobiolĂłgico (Figura 3) que involucra los sistemas
respiratorio y nervioso que ha permitido mejorar nuestra comprensiĂłn de la
percepciĂłn de la disnea.35
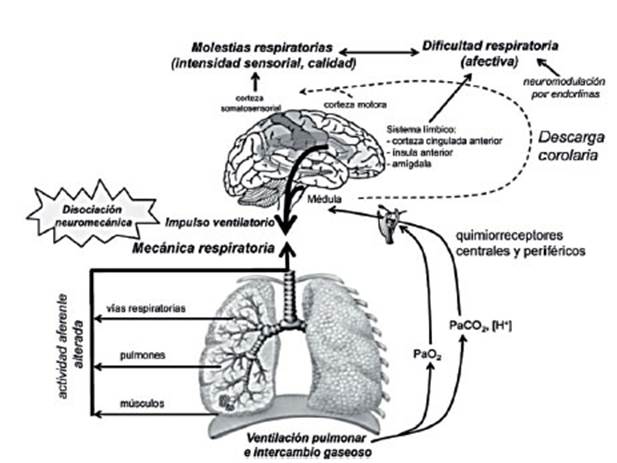
El
sistema respiratorio está modulado por neuÂropĂ©ptidos
excitadores e inhibidores que actĂşan desde las neuronas sensoriales hasta las
redes cenÂtrales. Los opioides endĂłgenos son neuropĂ©ptidos
inhibidores que afectan el ritmo respiratorio y la nocicepciĂłn.
Cuando se administra naloxona 10 mg IV para bloquear
la señalizaciĂłn del receptor opioide, los pacientes con EPOC refirieron punÂtuaciones
más altas de dificultad respiratoria en comparación con la administración
salina normal, tanto durante el ejercicio como con la respiraciĂłn con carga
resistiva. Estos resultados sugieren que los opioides endĂłgenos modifican la
disnea cuando actĂşan en el SNC. Los opioides modulan la percepÂciĂłn de la
disnea disminuyendo el impulso central respiratorio (y la descarga corolaria asociada), alterando la percepciĂłn central o
disminuyendo la ansiedad.7, 35
El
miedo a la sobredosis y al desarrollo de depresiĂłn respiratoria histĂłricamente
ha limiÂtado el uso de opioides para aliviar la disnea en la práctica clĂnica.
Sin embargo, recientes declaraciones de dos importantes sociedades neumonolĂłgicas mundiales27, 36 recomiendan que
los opioides orales y parenterales sean utilizados para el alivio de la disnea
refractaria. La disnea refractaria se definió como “disnea que persiste en
reposo o con actividad mĂnima y es angustiante a pesar del tratamiento Ăłptimo
de la enfermedad pulmonar o cardĂaca avanzada”. Además de una titulaciĂłn
adecuada, la comunicación es esencial entre médicos, pacientes y miembros de la
familia cuando se usan opioides para cuidados paliativos y al final de la vida.36
La
American Thoracic Society
propuso en 2012 que la disnea sea considerada en tres constructos:
sensorial, afectivo y el impacto o la carga de los sĂntomas (Tabla 3).36
La intensidad (sensorial) y la angustia (afectiva) en respuesta ante un
estĂmulo especĂfico, ya fue comentada. El impacto de la disnea en las
actividades diarias de un individuo puede considerarse ya sea durante la
atenciĂłn del paciente, o bien, en un ensayo clĂnico. La mayorĂa de los
instrumentos actualmente utilizados para cuantificar la disnea en ensayos
clĂnicos son de relativamente reciente desarrollo, apenas datan de unos 30 años
(Tabla 3).

El
modelo neurofisiolĂłgico proporciona un marÂco conceptual para mejorar nuestra comprensiĂłn
de los mecanismos que contribuyen a la percepciĂłn de la disnea. El sistema
opioide desempeña un papel importante en el alivio de la disnea. Tanto los
opioides endĂłgenos (b-endorfinas) como los exĂłgenos (morfino
sĂmiles) modulan la disnea. Las intervenciones que estimulan la liberaciĂłn de
opioides endĂłgenos requieren una investigaciĂłn para aliviar la disnea.7
CONCLUSIONES
La
visiĂłn de Comroe sobre la disnea como un fenĂłmeno del
sistema nervioso central y con dimensiones tanto sensoriales como afectivas fue
premonitoria y ahora ha sido confirmada en estudios de neuroimágenes.
Ayer como hoy, la disnea es una experiencia primaria asociada con
comportamientos destinados a contrarrestar una amenaza a la supervivencia. Se
ha establecido firÂmemente que la disnea es una experiencia compleja de la
mente y el cuerpo, que comprende diferentes sensaciones que solo pueden ser
percibidas por el individuo. Los componentes afectivos impulsan los
sentimientos acompañantes de angustia, miedo y ansiedad, y es el cerebro, no
los pulmones, el que genera estos fenĂłmenos.7, 36-38
BIBLIOGRAFĂŤA
1. Mahler D. Dyspnea. Medicine & Science in Sports & ExÂercise. 1991;23:1322. http://dx.doi.org/10.1249/00005768-199111000-00027
2. Donald A, Mahler DO. Dyspnea, Mechanisms, MeasureÂment and
Management. Donald A. Mahler DO, editor. CRC Press;
2005. (2nd Edition).
3. Stevens SS. On
the psychophysical law. Psychol Rev. 1957;64:153-81. https://doi.org/10.1037/h0046162
4. Borg GA. Psychophysical bases
of perceived exertion. Med Sci
Sports Exerc. 1982;14:377-81.
https://doi.org/10.1249/00005768-198205000-00012
5. Bakers JH, Tenney
SM. The perception of some sensations associated with breathing. Respir Physiol. 1970;10:85-92.
https://doi.org/10.1016/0034-5687(70)90029-0
6. Roussos C, Macklem
PT. The Thorax. Roussos C, Macklem PT, editors. Vol. 42. Marcel Decker; 1986.
https://doi.org/10.1016/S0003-4975(10)61851-6
7.
Mahler DA, O’Donnell DE. Recent advances in
dysÂpnea. Chest. 2015;147:232-41.
https://doi.org/10.1378/chest.14-0800
8.
Dyspnea. Mechanisms, assessment, and management: a consensus
statement. American Thoracic Society. Am J Respir Crit Care Med. 1999;159:321-40. https://doi.org/10.1164/ajrccm.159.1.ats898
9. Simon PM, Schwartzstein
RM, Weiss JW, et al. DistinÂguishable sensations of breathlessness induced in
normal volunteers. Am Rev Respir Dis. 1989;140:1021-7.
https://doi.org/10.1164/ajrccm/140.4.1021
10. Simon PM, Schwartzstein
RM, Weiss JW, Fencl V, TeghtÂsoonian
M, Weinberger SE. Distinguishable types of dyspnea in patients with shortness
of breath. Am Rev Respir Dis. 1990;142:1009-14.
https://doi.org/10.1164/ajrccm/142.5.1009
11. Hardie
GE, Brown JK, Gold WM. Bronchial hyperresponÂsiveness,
word descriptors, and ethnicity: women with mild asthma. J Asthma.
2012;49:36-44.
https://doi.org/10.3109/02770903.2011.637839
12.
Frankstein SI, Smolin LN, Sergeeva ZN, Sergeeva TI. Cortical representation of the phrenic nerve. Exp Neurol. 1979;63:447-
9. https://doi.org/10.1016/0014-4886(79)90139-0
13. Davenport PW, Cruz M, Stecenko AA, Kifle Y.
Respiratory-related evoked potentials in children with life-threatening asthma.
Am J Respir Crit Care Med.
2000;161:1830-5.
https://doi.org/10.1164/ajrccm.161.6.9903077
14.
Nicot FJ, Renault FR, Flores-Guevara RR. Respiratory-related evoked potentials in children with neuromuscular
diseases. Clinical Neurophysiology. 2012;123:e26-7. http://dx.doi.org/10.1016/j.clinph.2011.11.117
15. Nishino T. Dyspnoea: underlying mechanisms and treatment. Br J Anaesth. 2011;106:463-74.
https://doi.org/10.1093/bja/aer040
16. Herigstad
M, Hayen A, Wiech K, Pattinson KTS. Dyspnoea and the brain. Respir Med. 2011;105:809-17. https://doi.org/10.1016/j.rmed.2010.12.022
17. Marlow LL, Faull OK, Finnegan
SL, Pattinson KTS. Breathlessness and the brain: the
role of expectation. Curr Opin Support Palliat
Care. 2019;13:200-10.
https://doi.org/10.1097/SPC.0000000000000441
18. Frazier DT, Revelette WR. Role of phrenic nerve
afferents in the control of breathing. J Appl
Physiol. 1991;70:491-6.
https://doi.org/10.1152/jappl.1991.70.2.491
19. Bałkowiec
A, Kukuła K, Szulczyk
P. Functional classificaÂtion of afferent phrenic nerve fibres
and diaphragmatic receptors in cats. J Physiol. 1995;483:759-68.
https://doi.org/10.1113/jphysiol.1995.sp020620
20. Jammes
Y, Balzamo E. Changes in afferent and efferent
phrenic activities with electrically induced diaphragÂmatic fatigue. J Appl Physiol. 1992;73:894-902.
https://doi.org/10.1152/jappl.1992.73.3.894
21. Nair J, Streeter KA, Turner
SMF, Sunshine MD, Bolser DC, Fox EJ, et al. Anatomy
and physiology of phrenic afferent neurons. J Neurophy
K, H siol. 2017 Dec 1;118(6):2975-90.
https://doi.org/10.1152/jn.00484.2017
22. Corfield
DR, Fink GR, Ramsay SC, Murphyarty HR, Watson JD, et
al. Evidence for limbic system activation during CO2- stimulated
breathing in man. J Physiol. 1995;488:77-84.
https://doi.org/10.1113/jphysiol.1995.sp020947
23. Straus C, Zelter
M, Derenne JP, Pidoux B, Willer JC, Similowski T. Putative
projection of phrenic afferents to the limbic cortex in humans studied with
cerebral-evoked potentials. J Appl Physiol. 1997;82:480-90. https://doi.org/10.1152/jappl.1997.82.2.480
24. De Vito EL, Roncoroni AJ, Berizzo EE, Pessolano F. EfÂfects of spontaneous and hypercapnic hyperventilation on inspiratory effort
sensation in normal subjects. Am J Respir Crit Care Med. 1998;158:107-10.
https://doi.org/10.1164/ajrccm.158.1.9709098
25. Evans KC, Banzett
RB, Adams L, McKay L, Frackowiak RS, Corfield DR. BOLD fMRI identifies limbic, paralimÂbic, and cerebellar activation during air hunger. J NeuÂrophysiol. 2002;883:1500-11. https://doi.org/10.1152/jn.2002.88.3.1500
26. Mahler DA. Understanding mechanisms
and documentÂing plausibility of palliative interventions for dyspnea. Curr Opin Support Palliat Care.
2011;5:71-6.
http://dx.doi.org/10.1097/spc.0b013e328345bc84
27. Parshall
MB, Schwartzstein RM, Adams L, et al. An OfÂficial
American Thoracic Society Statement: Update on the Mechanisms, Assessment, and
Management of Dyspnea. Am Jf Resp
Crit Care Med. 2012;185:435-52.
https://doi.org/10.1164/rccm.201111-2042ST
28. Carrieri-Kohlman
V, Donesky-Cuenco D, Park SK, Mackin
L, Nguyen HQ, Paul SM. Additional evidence for the affective dimension of
dyspnea in patients with COPD. Res Nurs
Health. 2010;33:4-19.
https://doi.org/10.1002/nur.20359
29. Banzett RB, Pedersen SH, Schwartzstein
RM, Lansing RW. The affective
dimension of laboratory dyspnea: air hunger is more unpleasant than
work/effort. Am J Respir Crit
Care Med. 2008;177:1384-90.
https://doi.org/10.1164/rccm.200711-1675OC
30. Scano
G, Gigliotti F, Stendardi
L, Gagliardi E. Dyspnea and emotional states in
health and disease. Respir Med. 2013;107:649-55. https://doi.org/10.1016/j.rmed.2012.12.018
31. Davenport PW, Reep RL, Thompson FJ. Phrenic nerve
afferent activation of neurons in the cat SI cerebral corÂtex. J
Physiol. 2010;588t:873-86.
https://doi.org/10.1113/jphysiol.2009.181735
32. Casey KL. Forebrain
mechanisms of nociception and pain: Analysis through imaging]. Proceedings of the NaÂtional Academy of Sciences. 1999;96:7668-74. http://dx.doi.org/10.1073/pnas.96.14.7668
33. De Peuter
S, Van Diest I, Lemaigre V,
Verleden G, Demedts M, Van
den Bergh O. Dyspnea: the role of psychological processes. Clin
Psychol Rev. 2004;24:557-81.
https://doi.org/10.1016/j.cpr.2004.05.001
34. Santiago TV, Edelman NH. Opioids and breathing. J Appl
Physiol. 1985;59:1675-85.
https://doi.org/10.1152/jappl.1985.59.6.1675
35. O’Donnell DE, Ora J, Webb KA, Laveneziana P,
Jensen D. Mechanisms of activity-related dyspnea in pulmonary disÂeases. Respir Physiol Neurobiol. 2009;167:116-32.
https://doi.org/10.1016/j.resp.2009.01.010
36. Marciniuk
DD, Goodridge D, Hernandez P, et al. Managing dyspnea
in patients with advanced chronic obstructive pulmonary disease: a Canadian
Thoracic Society clinical practice guideline. Can Respir
J. 2011;18:69-78. https://doi.org/10.1155/2011/745047
37.
Comroe JH, Foster RE, Dubois
AB, Briscoe WA, Carlsen E.
El pulmĂłn. FisiologĂa clĂnica y pruebas funcionales pulmonares. Editorial
Universitaria; 1964.
38.
Comroe JH. Dyspnea. Mod Concepts Cardiovasc
Dis. 1956;25:347-9.