Autor : Luque, Graciela F.3, Melillo, Karina C.3, Lombardero, Lorena A.3, GonzĂĄlez, Norma E.4, Bisero, Elsa D.3
Grupo de Estudio DiagnĂłstico de TB : GonzĂĄlez, Claudio D.1; SĂmboli, Norberto F.2; Bisero, Elsa D.3; Luque, Graciela F.3; Melillo, Karina C.3; Lombardero, Lorena A3; GonzĂĄlez, Norma E.4; Amiano, NicolĂĄs O.5; GarcĂa, VerĂłnica E.5; DurĂŠ, Roberto M6; Armitano, Rita I.7; Fruhwald, Gladys E.8; Cerqueiro, MarĂa C.9
1Unidad NeumotisiologĂa, Hospital General de Agudos JosĂŠ M. Ramos MejĂa, Ciudad de Buenos Aires. Argentina.
2Servicio de Micobacterias del Instituto Nacional de Enfermedades Infecciosas Dr. Carlos G. MalbrĂĄn, INEI-ANLIS. Ciudad de Buenos Aires, Argentina.
3Servicio de PediatrĂa. SecciĂłn NeumonologĂa Infantil, Hospital Nacional Prof. Dr. Alejandro Posadas. El Palomar, Provincia. de Buenos Aires. Argentina.
4 Unidad NeumotisiologĂa, Hospital General de NiĂąos Pedro de Elizalde. Ciudad de Buenos Aires. Argentina.
5Investigadores del CONICET. Laboratorio de Inmunidad y Tuberculosis del Instituto de QuĂmica BiolĂłgica, Facultad de Ciencias Exactas y Naturales (IQUIBIÂCEN), Universidad de Buenos Aires (UBA), Ciudad de Buenos Aires. Argentina.
6Unidad de Broncoscopia Hospital de Infecciosas Francisco J. MuĂąiz. Ciudad de Buenos Aires. Argentina.
7Laboratorio de Micobacterias. Hospital General de Agudos Parmenio PiĂąero. Ciudad de Buenos Aires. Argentina.
8Servicio de NeumonologĂa de la Obra Social del Personal de Edificios de Renta y Horizontal (OSPERYH).
9Consultora de la SecciĂłn TisiologĂa. Hospital de NiĂąos Dr. Ricardo GutiĂŠrrez. Ciudad de Buenos Aires. Argentina.
https://doi.org/10.56538/ramr.LHTR8425
Correspondencia : Claudio D. GonzĂĄlez. E-mail: claudiodgonzalez57@gmail.com
Recibido: 11/10/2022
Aceptado: 01/11/2023
DIAGNĂSTICO DE TB EN PACIENTES PEDIĂTRICOS
1. Abordaje al diagnĂłstico de tuberculosis infantil (TBI)
Dra. Elsa BiserĂł
La
incidencia de TB infantil (TBI) es, a menudo, subestimada debido a la
dificultad de diagnosticar la enfermedad en los niĂąos. La presentaciĂłn clĂnica de
la TB en pediatrĂa muestra una gran variabilidad, con formas, en ocasiones, oligosintomĂĄticas que debutan de manera larvada. Los
pediatras debemos hacer un esfuerzo para conocer esta enfermedad y evitar su
progresiĂłn a formas graves, lo que contribuye a su control epidemiolĂłgico.
En
el 2020 la OMS estimĂł que por aĂąo, en todo el mundo, 1.100. 000 niÂĂąos menores
de 15 aĂąos, enferman de TB, de ellos 226. 000 pierden la vida. Representa
aproximadamente el 11 % del nĂşmero total de casos de TB. El 80 % de esas
muertes se produce entre niĂąos menores de 5 aĂąos de edad y el 17 %, en
pacientes infectados por el VIH. Se estima que entre 25 000 y 32 000 niĂąos
menores de 15 aĂąos desarrollan tuberculosis multirresistente
(MDR-TB) cada aĂąo, de ellos, solo 12. 220 iniciaron tratamiento entre 2018 y
2020.1, 2
En
la Argentina, durante el 2020, se notificaron 10 896 casos de tuberÂculosis, de
los cuales 10 268 fueron nuevos y recaĂdas. El 17 % de los casos corresponde a
niĂąos, niĂąas y adolescentes. El 76,9 % de los casos nuevos diagnosticados
fueron con localizaciĂłn pulmonar.3
La
TBI se puede diagnosticar de una manera relativamente sencilla y curarse en la
gran mayorĂa de los casos con tratamientos de bajo costo y bien tolerados. Pese
a esto, sigue implicando un desafĂo para la salud pĂşblica.4
El
propĂłsito del capĂtulo es proporcionar lineaÂmientos adecuados en la
metodologĂa diagnĂłstica, describir sus caracterĂsticas (rendimientos en
sensibilidad y especificidad) y formular las recoÂmendaciones para su uso.
La
meta es establecer un conjunto de recoÂmendaciones para detectar casos
sospechosos de TBI, con base en la mejor evidencia cientĂfica disponible, asĂ
como en el consenso de expertos en la materia.
La
misiĂłn de este apartado se dirige a detectar a los niĂąos con TB y la visiĂłn
estĂĄ construida en funciĂłn de las necesidades de los pacientes, de los
requerimientos del sistema y la calidad de vida de las personas.
El
objetivo general de este capĂtulo es el de proveer herramientas actualizadas
para el diagÂnĂłstico de TBI.
2. El papel de la anamnesis en el diagnĂłstico de TBI
Dra. Karina Melillo
La
anamnesis es fundamental y debe ser minuciosa y sistemĂĄtica. El primer paso
para el diagnĂłstico es sospechar la posibilidad de TB. Ante cualquier consulta
ambulatoria u hospitalaria, es perentorio recabar informaciĂłn personal y del
entorno sobre manifestaciones de patologĂa crĂłnica compatibles con TB. Al
realizar una detallada anamnesis, deben considerarse aspectos epidemiolĂłgicos
importanÂtes tanto para el paciente como tambiĂŠn desde el punto de vista de la
salud pĂşblica. Esta evaluaciĂłn comprende diferentes aspectos.
Como
antecedentes personales, se tienen en cuenta la vacunaciĂłn BCG, la existencia
de cicatriz posvacunal y de una prueba tuberculĂnica (PT) preÂvia, su fecha de realizaciĂłn y
resultado. Si recibiĂł tratamientos antituberculosos o quimioprofilaxis previos,
se debe determinar la fecha, las drogas, la duraciĂłn, las intolerancias, los
abandonos o las interrupciones, detectar comorbilidades, inmuÂnodeficiencias y
posibles tratamientos inmunoÂsupresores.
En
cuanto a los antecedentes familiares, se debe preguntar si hay estudios de
foco, la historia de los casos de TB actuales o en los Ăşltimos dos aĂąos en el
entorno del paciente, la clĂnica presenÂtada y las medidas terapĂŠuticas
llevadas a cabo. Es importante especificar el tiempo de exposiciĂłn, si se trata
de un caso bacilĂfero o cavitario,
resistente o no a las drogas, registrar el cumplimiento del traÂtamiento y
asegurarse del estudio completo de los contactos. Asimismo, debe mantenerse una
fluida comunicaciĂłn con los profesionales que controlan el caso Ăndice.
Si
el niĂąo es el caso Ăndice, es decir durante la anamnesis no surge ningĂşn
enfermo de TB coÂnocido, se debe buscar el foco bacilĂfero
entre los contactos SR, ya que puede tratarse de un paciente que aĂşn no ha sido
diagnosticado.5-7
En
el niĂąo, la TB se considera un evento centiÂnela, que indica transmisiĂłn
comunitaria reciente desde un adulto bacilĂfero.7, 8
Todos
los niĂąos en riesgo de tener TB deberĂan ser estudiados y clasificados como
expuestos, infectados o enfermos. Cada estadio conlleva una actitud terapĂŠutica
distinta y existen ciertos factoÂres como antecedentes de enfermedad actual que
deben evaluarse con detenimiento.8
La
edad en que se produce la infecciĂłn y el estado inmunitario son las dos
variables mĂĄs importantes que determinan el paso a la enfermedad. Los bebĂŠs y
los niĂąos pequeĂąos (especialmente los menores de 2 aĂąos) tienen una alta
probabilidad de desarrollar enfermedad activa, la mayorĂa dentro del aĂąo de
producida la primoinfecciĂłn.9 AdemĂĄs, estos
niĂąos pequeĂąos tienen mayor riesgo de desarrollar formas graves y diseminadas,
a menudo, mortales. El riesgo es menor en aquellos entre los 5 y los 10 aĂąos de
edad y vuelve a aumentar en la adolescencia. Debe tenerse en cuenta que la
mayorĂa de los niĂąos inmunocompetentes infectados por
M. tuberculosis no enfermarĂĄn, pero los inmunoÂdeficientes
deben ser estudiados siempre en las ĂĄreas prevalentes de TB.8
La
detecciĂłn sistemĂĄtica de la enfermedad tuberculosa en los niĂąos es un desafĂo.
Las herraÂmientas para su diagnĂłstico son menos precisas en los niĂąos que en
los adultos. Los niĂąos tienen menor rentabilidad de las pruebas
microbiolĂłgicas. La confirmaciĂłn bacteriolĂłgica en la poblaciĂłn pediĂĄtrica se
logra en menos de 40 % de los casos. En razĂłn de que el mĂŠtodo de referencia (gold standard) para
el diagnĂłstico continĂşa siendo la detecciĂłn del M. tuberculosis directamente
en muestras biolĂłgicas o su cultivo en medios espeÂcĂficos, la demora en la
espera de los resultados favorece el diagnĂłstico y tratamientos tardĂos.
3. El rol de la clĂnica en el diagnĂłstico de TBI
La
presentaciĂłn clĂnica de la TB es muy vaÂriable y puede ser poco expresiva (en
la mayor parte de los casos), lo que conlleva demoras diagÂnĂłsticas, progresiĂłn
de la enfermedad y nuevos contagios.
El
comienzo suele ser insidioso y crĂłnico. El cuadro clĂnico difiere segĂşn la
edad, el tipo de TB (primaria o extraprimaria), la
extensiĂłn de la enfermedad y el estado inmunolĂłgico del paciente.
La
forma mĂĄs comĂşn de presentaciĂłn de TB en los niĂąos es la forma
ganglio-pulmonar, y la mayor parte de estos pacientes van a presentar pocos
sĂntomas o estar asintomĂĄticos.8
Los
signos y sĂntomas resultan de la compreÂsiĂłn de la vĂa aĂŠrea y el parĂŠnquima
por ganglios linfĂĄticos aumentados, lo que es mĂĄs frecuente en bebĂŠs y niĂąos
pequeĂąos debido al menor caliÂbre de las vĂas aĂŠreas. Suelen presentar tos seca
(persistente de mĂĄs de dos semanas), disnea leve y sibilancias persistentes
fijas y asimĂŠtricas que no responden a tratamiento broncodilatador, con
taquipnea o sin esta. En los menores de 3 aĂąos, el cuadro clĂnico puede
mimetizar infecciones virales, lo que genera dificultades diagnĂłsticas. El descenso
o mal progreso de peso junto con la fiebre (con sudoraciĂłn nocturna o sin
esta), se van instalanÂdo con la progresiĂłn de la enfermedad, alcanzan una
sensibilidad del 89 % y una especificidad del 69 % para detecciĂłn de TBI.4 En niĂąos
menores de 3 aĂąos, la sensibilidad cae al 50 %. En ellos, es importante
pesquisar letargia y disminuciĂłn de la actividad (disminuciĂłn del juego), la
tos puede esÂtar ausente.10,
11 Una
revisiĂłn reciente de Cochrane los autores concluyen que la combinaciĂłn de uno o
mĂĄs de los sĂntomas, tendrĂan una sensibilidad del 89 % para detectar TB
pulmonar en niĂąos en contacto cercano con casos de TB.11
El diagnĂłstico de TB debe ser excluido tambiĂŠn en niĂąos con neuÂmonĂa
graves, que no mejora con el tratamiento antimicrobiano adecuado, o con derrame
pleural (mĂĄs frecuente en menores de 2 aĂąos e inmunosuÂprimidos),
lo que eleva el grado de sospecha (vĂŠase la Tabla 1).2, 7, 8, 12-14
Al
final de la infancia y en la adolescencia (≥10 aĂąos de edad) se pueden
presentar formas primaÂrias como la descrita o formas extraprimarias
de reinfecciĂłn (endĂłgena o exĂłgena), similares a las que encuentran en los
adultos. Es mĂĄs probable que estos pacientes experimenten los sĂntomas clĂĄsicos
de impregnaciĂłn bacilar, como fiebre vespertina, anorexia, malestar general,
pĂŠrdida de peso (documentado en los Ăşltimos 3-6 meses, o pĂŠrdida mayor del 10 %
del peso en cualquier intervalo de tiempo, sin respuesta al tratamiento
nutricional), sudores nocturnos, tos persistente de mĂĄs de dos semanas de
duraciĂłn, seca o proÂductiva con expectoraciĂłn mucosa purulenta y o hemoptoica,
dolor de pecho de tipo pleurĂtico y hemoptisis. Los hallazgos en el examen
fĂsico suelen ser menores que en los niĂąos pequeĂąos o, incluso, estar ausentes.
La mayorĂa presentan auscultaciĂłn respiratoria normal, aun cuando hay cavidades
o grandes infiltrados.10,
13
En
las formas extrapulmonares, predomina la signo-sintomatologĂa sugestiva correspondiente al Ăłrgano,
aparato o sistema implicado.10
â˘
AdenopatĂa no dolorosa especialmente mayor de 2 Ă 2 cm con fĂstula o sin esta.
TB ganglionar.
â˘
Cifosis espinal de ĂĄngulo estrecho (hinchazĂłn angular), especialmente si es de
apariciĂłn reÂciente (gibbus). TB espinal.
â˘
Signos de meningitis no aguda (apariciĂłn duranÂte mĂĄs de 5 d), especialmente si
no responde a tratamiento antibiĂłtico o con presiĂłn intracraÂneal elevada. TB
menĂngea.
â˘
Derrame pleural, especialmente matidez unilaÂteral con dolor pleurĂtico en un
niĂąo que no estĂĄ agudamente enfermo. TB pleural.
â˘
Derrame pericĂĄrdico, ruidos cardĂacos distantes o apagados o signos de
insuficiencia cardĂaca de nueva apariciĂłn. TB pericĂĄrdica.
â˘
Abdomen distendido no agudo con ascitis o sin esta. TB abdominal.
â˘
Articulaciones hinchadas no dolorosas con marÂcha dolorosa o anormal. TB osteoarticular.
Tener
en cuenta el eritema nodoso y la queÂratoconjuntivitis
flictenular, que son manifesÂtaciones de hiperergia a
las proteĂnas del bacilo de Koch y sugieren infecciĂłn tuberculosa reciente.
Con
el concepto de un proceso continuo entre dos extremos que van de infecciĂłn por MycobacÂterium tuberculosis (Mtb) a enfermedad por TB, se incorporaron recientemente dos
estadios interÂmedios, descriptos como TB incipiente, que es la etapa siguiente
a la infecciĂłn llamada hasta ahora TB latente (TBL), bacilos durmientes
alternan con perĂodos de replicaciĂłn lenta e intermitente. El paciente
probablemente no tiene capacidad de transmitir la enfermedad. Los mĂŠtodos de
diagnĂłstico de infecciĂłn, IGRAS y la PPD son poÂsitivos. No se cuenta con
mĂŠtodos validados para el diagnĂłstico de este estadio. En esta etapa, es
promisorio el desarrollo de biomarcadores capaces de
detectarla y evitar su progreso a TB subclĂnica y TB subclĂnica, etapa en que
los bacilos metaÂbĂłlicamente activos se estĂĄn replicando y es potenÂcialmente
infecciosa. Se caracteriza por ausencia de sĂntomas y signos clĂnicos, o por
presentarlos en forma leve sin percepciĂłn por parte del paciente, lo que
favorece la diseminaciĂłn de la enfermedad hacia la comunidad. Esto tiene
implicancias muy negativas en menores de 5 aĂąos y, en especial, en los menores
de 2 aĂąos, en los cuales el riesgo de enfermar y desarrollar formas graves es
mayor. Las herramientas para su detecciĂłn son las imĂĄgenes y pruebas
microbiolĂłgicas.15
En
resumen: No hay hallazgos clĂnicos que confirmen el diagnĂłstico de TBI, sin
embargo, existen signos que deben elevar el grado de sosÂpecha. Un algoritmo
basado exclusivamente en signo sintomatolĂłgica es insuficiente. Basarse
exclusivamente en sĂntomas conlleva un riesgo de un 30 % de estudiar o tratar a
niĂąos que no estĂĄn enfermos por TB.4, 8, 10 Las guĂas recomiendan complementar con estudios microbiolĂłgicos y de
imĂĄgenes, lo que aumenta la posibilidad de arribar a un diagnĂłstico de TB.2
4. La funciĂłn de los anĂĄlisis clĂnicos
Dra. Lorena
Lombardero
Los
hallazgos suelen ser inespecĂficos y los resulÂtados son solo orientadores:
anemia hipocrĂłmica ferropĂŠnica
moderada, eritrosedimentaciĂłn (ESD) ≥ 80 mmÂł en
la primera hora (puede superar los 100/mmÂł en pacientes con VIH/sida), proteĂna
C reactiva elevada (≥ 10 mg/L), leucocitosis con neutrofilia
y desviaciĂłn a la izquierda del Ăndice de Schilling.
Como
ocurre con otros reactantes de fase aguda la proteĂna C reactiva, tiene buena
sensibilidad; en paĂses con alta prevalencia de TB, ronda el 90 %, pero su
especificidad es baja (53 % a 75 %).15
La
concentraciĂłn de proteĂna C reactiva tambiĂŠn estĂĄ elevada en los derrames
pleurales por TB, si es mayor de 50 mg /L tiene una especificidad del 95 %. La
ADA es un biomarcador sensible y especĂfico (varĂa
entre el 88 % y el 100 %, y entre el 81 % y el 97 %, respectivamente) de la TB
pleural, especialÂmente en regiones con prevalencia de la enfermedad media o
alta y tiene una efectividad diagnĂłstica similar en pacientes con VIH, incluso
aquellos con niveles bajos de linfocitos CD4. La isoenzima
ADA2 que predomina en monocitos y macrĂłfagos repreÂsenta el 88 % del total de
la actividad de la ADA en la TB pleural. La relaciĂłn lĂĄctico-deshidrogenasa
LDH/ADA puede discriminar entre exudado tuberÂculoso y derrame paraneumĂłnico, especialmente cuando el punto de corte es
mĂĄs bajo.16, 17
Otros
marcadores eficientes de la TB pleural son la citoquina IFN-γ ≥ 75 pg/mL, la interleucina 27 (IL-27)
o lisozima >15 mg/dL (cociente lisozima en
lĂquido/lisozima en suero mayor de 1,2) podrĂan ser Ăştiles en la TB pleural,
pero mĂĄs costosos.18
5. El papel de la prueba tuberculĂnica
en el diagnĂłstico de TBI
Dra. Graciela Luque
Es
el mĂŠtodo mĂĄs Ăştil para el diagnĂłstico de inÂfecciĂłn tuberculosa y es de gran
ayuda para el de enfermedad tanto en niĂąos como en adolescentes. Es un mĂŠtodo
cuantitativo, de mediciĂłn de la reacÂciĂłn de hipersensibilidad retardada a las
proteĂnas del derivado proteico purificado âPPDâ (hiperergia tuberculĂnica). Solo evidencia contacto previo del
individuo con el bacilo.
La
tĂŠcnica debe ser rigurosa y realizada por personal entrenado. Se recomienda
utilizar la tĂŠcnica de Mantoux, con lectura 72 h
despuĂŠs de la inyecciĂłn. Se mide la reacciĂłn con la induraÂciĂłn producida,
medida en milĂmetros sobre el diĂĄmetro mĂĄximo, transversal al eje mayor del
antebrazo. El eritema no es tenido en cuenta. La induraciĂłn positiva o la
apariciĂłn de vesĂculas o necrosis es indicativa de
infecciĂłn por TB. En la Tabla 2, se expresan los valores de corte utilizaÂdos
en nuestro paĂs para la interpretaciĂłn de los resultados.3, 19
Las
investigaciones epidemiolĂłgicas han indicaÂdo que el componente genĂŠtico del
huĂŠsped conÂtribuye a los fenotipos de infecciĂłn y enfermedad, lo que influye
tanto en la susceptibilidad como en la resistencia. Aproximadamente el 30 %-50
% de los contactos convivientes expuestos no se infecÂtan. Varios estudios familiares
han proporcionado evidencia consistente de un papel importante de la genĂŠtica
humana en el control de la infecciĂłn por M. tuberculosis o la
reactividad a la PPD.20

ConversiĂłn o viraje tuberculĂnico
Se
define conversiĂłn o viraje tuberculĂnico cuando un
sujeto tuberculino negativo se convierte en tuberculino positivo o se presenta una diferencia de mĂĄs de
10 mm entre una y otra lectura en un plazo inferior a 2 aĂąos. Se estima que
esto repreÂsenta una infecciĂłn reciente.19 La negatividad de la PT
en los niĂąos no excluye el diagnĂłstico de infecciĂłn o enfermedad tuberculosa,
por lo cual debe tenerse en cuenta que no constituye un eleÂmento diagnostico
en sĂ mismo, sino un criterio mĂĄs que considerar presente reacciĂłn frente a la
tuberculina, positiva.
Inconvenientes
de la tuberculina: Algunos de los constituyentes proteicos del PPD son comÂpartidos
por micobacterias ambientales y por M. bovis (BCG), hecho que disminuye la especificidad de la
prueba. La falta de los resultados por ausenÂtarse en la segunda visita de
lectura, empeorado por no poder repetirse inmediatamente.21
En
la Tabla 3, se resumen las ventajas y desvenÂtajas que aporta la PT.

Pruebas mĂĄs recientes
en el diagnĂłstico de la infecciĂłn
Las
nuevas pruebas para diagnosticar la infecciĂłn por TB se basan en conceptos
similares a la PPD e IGRA, es decir, provocar una respuesta inmune a antĂgenos
especĂficos de M. tuberculosis, ya sea in vivo (tamaĂąo de la
induraciĂłn de la piel) o in vitro (magnitud de la liberaciĂłn de
citoquinas). AĂşn estĂĄ pendiente disponer de una prueba que no solo identifique
correctamente a los infectados sanos, sino a aquellos que tienen un riesgo
elevado de padecer la enfermedad para poder intervenir sobre ellos con un
tratamiento.
En
general, el rendimiento predictivo de cualÂquier nueva prueba para la infecciĂłn
por TB no debe ser inferior a la tecnologĂa actual. Los IGRA (QFT y T-SPOT) se
han convertido en pruebas de rutina para diagnosticar la presunta infecciĂłn por
M. tuberculosis en paĂses de baja prevalencia, ya sea solas o en
combinaciĂłn con PPD.
Los
IGRA son mĂĄs especĂficos y requieren solamente una sola visita para la flebotomĂa.
Sin embargo, a menudo puede ser necesaria una segunda visita para aclarar el
resultado, descartar la TB activa y comenzar la prevenciĂłn. Los IGRA tambiĂŠn
tienen varios inconvenientes, entre ellos la necesidad de infraestructura comÂpleja
de laboratorio y transporte de muestras, costos mĂĄs altos, dentro de la
variabilidad de la persona y una alta proporciĂłn de resultados indeterminados
en el VIH avanzado y los niĂąos muy pequeĂąos. Pueden dar falsos positivos con micobacteriosis no tuberculosas, incluidas M. marinum y M. kansasii.21, 22
Otras
pruebas: C-Tb (Statens Serum
Institut Copenhagen, Denmark) y Diaskintest (CJSC Generium, Russia), son reacciones
cutĂĄneas que se basan en dos antĂgenos especĂficos del M. tuÂberculosis:
ESAT-6 y CFP-10. Se aplican y leen de la misma manera que la prueba tuberculĂnica con PPD. Utilizan una induraciĂłn de 5 mm de
punto de corte independientemente del estado de BCG, VIH o ambos. Los costos y
sensibilidad son similaÂres a la prueba de Mantoux.
Se pueden usar para testeos poblacionales y no tienen reacciĂłn cruzada con BCG.23,
24
ConclusiĂłn:
En el contexto de algoritmos de diagnĂłstico para la TB pediĂĄtrica, la prueba tuÂberculĂnica y los IGRA constituyen herramientas que
aportan especificidad, permiten identificar a los infectados sanos y a aquellos
en riesgo elevado de padecer enfermedad tuberculosa; no deben ser interpretadas
de forma aislada.
6. La funciĂłn del diagnĂłstico por imĂĄgenes en TBI
6.1. El rol de la radiografĂa y tomografĂa de tĂłrax
Dra. Norma GonzĂĄlez
La
radiografĂa (Rx) de tĂłrax es una herramienta valiosa
para el diagnĂłstico de TBI en pediatrĂa, porÂque muchos niĂąos presentan escasa
sintomatologĂa al inicio de la enfermedad y las lesiones pulmonares suelen ser
cerradas con poca cantidad de bacilos (paucibacilares),
lo que dificulta la confirmaciĂłn microbiolĂłgica.
Al
interpretar las imĂĄgenes del tĂłrax es neceÂsario reconocer las estructuras
normales como el timo o los vasos pulmonares para no catalogar equivocadamente
una Rx como patolĂłgica. En este sentido, una tĂŠcnica
radiolĂłgica inadecuada tamÂbiĂŠn puede confundir, ensanchando el mediastino o
aumentando la trama pulmonar, en placas en espiraciĂłn, rotadas o poco
penetradas. TambiĂŠn existe variabilidad de acuerdo interobservador
en la detecciĂłn e interpretaciĂłn de las imĂĄgenes, esÂpecialmente en los casos
de TB pulmonar primaria en niĂąos pequeĂąos.25
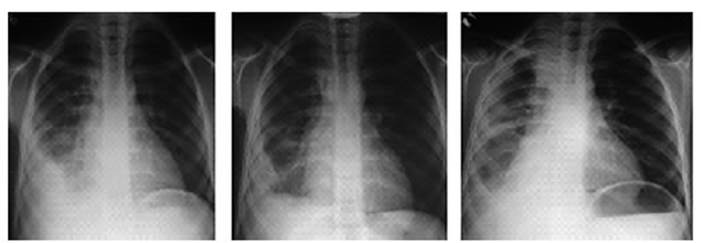
Las
adenomegalias intratorĂĄcicas, perihiliares
o paratraqueales son caracterĂsticas de la TB
primaria. Para identificarlas mejor, se prefiere evaluar el frente y el perfil
de la Rx de tĂłrax; esta Ăşltima proyecciĂłn permite
optimizar la visualiÂzaciĂłn de los ganglios linfĂĄticos del mediastino (Figura
1).
A
medida que la enfermedad avanza, las lesiones ganglionares intratorĂĄcicas
pueden comprimir las vĂas aĂŠreas y producir atelectasias (mĂĄs frecuentes en
lĂłbulo superior y medio derecho) o hiperinsuÂflaciĂłn.
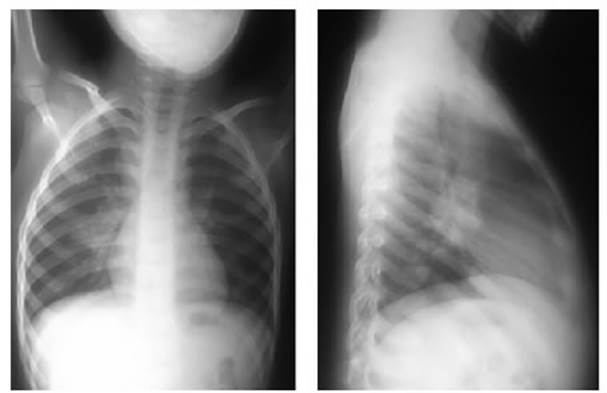
El
compromiso parenquimatoso pulmonar de la TB se manifiesta como neumonĂa o
broncoÂneumonĂa indistinguible radiolĂłgicamente de la producida por otros
gĂŠrmenes, pero la persistencia o el empeoramiento de estas imĂĄgenes a pesar de los
tratamientos antibiĂłticos adecuados inducen a sospechar TB (Figura 2).
Las
cavitaciones Ăşnicas o mĂşltiples, que se observan en el interior de opacidades de
bordes difusos, generalmente ubicadas en los campos suÂperiores, son altamente
sugestivas de TB. Suelen presentarse en niĂąos mayores de 10 aĂąos, SR, en los
que es mĂĄs frecuente la confirmaciĂłn bacterioÂlĂłgica. TambiĂŠn pueden cavitarse lesiones pulmoÂnares en niĂąos pequeĂąos con
evoluciĂłn tisiĂłgena de la enfermedad.
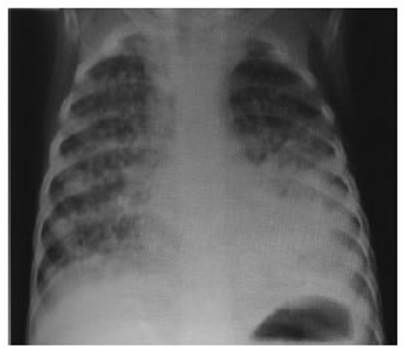
Otro
patrĂłn radiolĂłgico que obliga a pensar en TB es el micronodulillar
diseminado en ambos campos pulmonares, que caracteriza a la TB miÂliar26,
27 (Figura 3).
Muchos
niĂąos tienen antecedentes de episodios respiratorios previos o enfermedades
preexistentes como asma, secuelas posinfecciosas, VIH
o fibrosis quĂstica; en estos casos se debe comparar con las Rx previas del paciente. Al comparar las imĂĄgenes, se debe
pensar en los diagnĂłsticos diferenciales de las complicaciones que estas
entidades pueden presentar, y se deben buscar imĂĄgenes que hagan sospechar TB.
La
ecografĂa, realizada con tĂŠcnica adecuada para pacientes pediĂĄtricos y un
operador entreÂnado, puede ser Ăştil para detectar adenomegalias y derrame
pleural.28
La
tomografĂa de tĂłrax aumenta la precisiĂłn diagnĂłstica en los casos en los que la
Rx sea dudosa, especialmente para detectar
adenomegalias mediastiÂnales. Sin embargo, debe
tenerse en cuenta la mayor radiaciĂłn a la que se expone al paciente y la
necesidad de sedaciĂłn o anestesia que se necesita para obtener buenas imĂĄgenes
en lactantes y niĂąos pequeĂąos.29
Actualmente,
se encuentran en fase de desaÂrrollo y optimizaciĂłn para pacientes pediĂĄtricos
herramientas automatizadas, digitales (asistidas por computadora) y de telelectura para simplificar la interpretaciĂłn de hallazgos
de imĂĄgenes.28
6.2. El papel de la ecografĂa
Dra. Elsa Bisero
El
ultrasonido es Ăştil para identificar y caracteriÂzar lesiones en pleura, pared
torĂĄcica, diafragma y mediastino. Sus principales ventajas son las siguientes:
la ausencia de radiaciones ionizantes, la capacidad de exploraciĂłn en tiempo
real, la posibilidad de realizar el estudio en la cabecera del paciente, la
evaluaciĂłn de la extensiĂłn de la enfermedad y la de realizar la toma de
muestras, entre otras. Estas caracterĂsticas son de especial utilidad en las
personas mĂĄs susceptibles de padeÂcer los efectos adversos de la radiaciĂłn,
como los niĂąos y las embarazadas, o en pacientes de difĂcil movilizaciĂłn, como
los ingresados en unidades de cuidados intensivos.30
En
las enfermedades torĂĄcicas, la ecografĂa ha tenido un papel secundario o,
prĂĄcticamente nulo. Esto se debe a que un 99 % de los ultrasonidos que se
emiten por el transductor ecogrĂĄfico son repeliÂdos en la interfase
entre pleura y pulmĂłn, dado la gran diferencia de impedancia acĂşstica entre los
tejidos blandos y el aire y la gran atenuaciĂłn que sufren los ultrasonidos en
su propagaciĂłn a travĂŠs de un medio aĂŠreo.31
La
ecografĂa en niĂąos estĂĄ indicada en los siÂguientes casos:
Estudio de serosas
a.
Estudio de la pleura. Es mĂĄs precisa (senÂsibilidad del 100 % y especificidad
del 99,7 %) que la Rx convencional para detectar
derrames pleurales, ya que puede visualizar a partir de 5 mL
de lĂquido. El volumen del derrame pleural puede calcularse mediante diversas
ecuaciones basadas en la mediciĂłn del grosor lateral de la columna de lĂquido,
la altura del fluido subpulmonar y el grosor del
recubrimiento del pulmĂłn. El mĂŠtodo mĂĄs sencillo consiste en multiplicar el
grosor de la columna lateral de lĂquido (en mm) por un factor empĂrico de 90,
con lo que se obtiene el volumen de derrame pleural en mililitros (r = 0,68). Es
un procedimiento no invasivo, de bajo costo, muy empleado en TB pleural. El
aspecto ecogrĂĄfico de un derrame pleural depende de su naturaleza, causa y
cronicidad. Permite detectar tabiques (gruesos o finos y mĂłviles), las
caracterĂsticas del contenido (ecos internos), engrosamientos, obtener muestras
histolĂłgicas de lesiones pleuraÂles, con una tasa de ĂŠxito del 80 % y
seguimiento dinĂĄmico de las lesiones. Las tĂŠcnicas de drenaje pleural pueden
aplicarse mediante guĂa ecogrĂĄfiÂca, lo que permite colocar tubos de menor
calibre con una mayor precisiĂłn. La toracocentesis
con guĂa ecogrĂĄfica es por ello una tĂŠcnica segura y puede realizarse en
pacientes con ventilaciĂłn mecĂĄnica.31, 32
b.
Estudio del pericardio. En el diagnĂłstico de derrame pericĂĄrdico, el ecocardiograma
doppler color sirve, vez, para valorar las posibles
complicaÂciones, como taponamiento cardĂaco o pericarditis constrictiva.33
c.
Estudio de adenomegalias: Se define adenomegalia a la presencia de ganglios linfĂĄticos
mayores de 1 cm. de diĂĄmetro. El aumento de voÂlumen ganglionar obedece a
diversos mecanismos:
1.
EstimulaciĂłn antigĂŠnica repetida que lleva a hiperplasia folicular linfoide con
proliferaciĂłn de cĂŠlulas intrĂnsecas del ganglio (linfocitos o cĂŠlulas
plasmĂĄticas).
2.
InfiltraciĂłn por cĂŠlulas externas al ganglio (histiocitos en H. Langerhans,
enfermedades de depĂłsito).
3.
InfiltraciĂłn de polimorfo nucleares (adenitis infecciosas).
4.
InfiltraciĂłn por cĂŠlulas tumorales (en leucemias y tumores sĂłlidos).
Por
su evoluciĂłn las adenomegalias pueden ser agudas (<10 d de evoluciĂłn),
subaguda (entre 10 y 30 d) y crĂłnicas (>30 d de evoluciĂłn). Por su
ubicaciĂłn, localizadas y generalizadas.
Las
adenomegalias torĂĄcicas reciben la linfa del pulmĂłn, corazĂłn, timo y esĂłfago.
Pero en TB pueden manifestarse por tos, sibilancias, disfagia, hemoptisis,
erosiĂłn de la vĂa aĂŠrea, atelectasias, sintomatologĂa neurolĂłgica y obstrucciĂłn
de los grandes vasos (como la vena cava superior, con compromiso vital del
paciente).
La
ecografĂa permite, ademĂĄs, especificar tamaÂĂąo, forma, ecogenicidad,
vascularidad, contenido (sĂłlido o lĂquido), ver
compresiones y acceder a determinadas ĂĄreas del mediastino, en especial al
compartimiento anterior y a la ventana aorÂtopulmonar.
Se la emplea en imĂĄgenes dudosas mediastinales (sobre
todo en menores de 2 aĂąos), mediante abordajes supraesternal
y paraesternal. Se ha demostrado que hasta el 60 % de
los niĂąos asintomĂĄticos con TB y Rx de tĂłrax
interpretada como normal, presentan adenopatĂas mediastĂniÂcas,
en especial subcarinales. La sensibilidad global de
la ecografĂa para el estudio de adenopatĂas meÂdiastĂnicas
es del 62 %, y asciende hasta el 72 % si se consideran las regiones accesibles
del pulmĂłn. Guarda y colaboradores mencionan que las adeÂnopatĂas estĂĄn
presentes en un 95 % de los niĂąos, pero la radiografĂa puede no evidenciarlas.34-36
En
el trabajo de Lisa C. Ruby y colaboradores, se menciona que la proporciĂłn de
niĂąos con linfadeÂnopatĂa detectada por ecografĂa mediastĂnica oscilĂł entre el 15 % y el 85 %, y los estudios
que incluÂyeron la exploraciĂłn supraesternal y paraesternal lograron proporciones de detecciĂłn mĂĄs altas.
Tres estudios retrospectivos informaron linfadenopatĂa
mediastĂnica en la ecografĂa para la mayorĂa de los
casos que se presentaron con una Rx normal o no
concluyente.36
d.
Estudio de estructuras abdominales: Permite visualizar estructuras
ganglionares, en especial los grupos para aĂłrticos, para cava y meÂsentĂŠricos.
En TB los ganglios linfĂĄticos pueden ser discretos o presentarse como masas
opacas en conglomerados. Es habitual que los ganglios agrandados contengan
ĂĄreas centrales hipoecoicas o calcificaciones en las
etapas tardĂas de la TB. AdemĂĄs, la ecografĂa permite poner en evidencia
granulomas caseificantes sobre todo en hĂgado y bazo,
visualizar un complejo primario ganglionar en hilio hepĂĄtico (Ăşnica lesiĂłn
patognomĂłnica de TB congĂŠnita). Un inconveniente es que el gas intestinal puede
dificultar ver las diferentes estructuras.34, 37
La
ultrasonografĂa endoscĂłpica (USE) puede ayudar a obtener imĂĄgenes de lesiones
cercanas a la luz gastrointestinal, las cuales pueden ser aspiradas o biopsiadas mediante aspiraciĂłn con aguja fina. Se pueden
tomar biopsias especĂficas de los ganglios linfĂĄticos, el hĂgado y el pĂĄncreas.
La ecografĂa es Ăştil para obtener imĂĄgenes de la tuberculosis peritoneal.
6.3. EcografĂa endobronquial,
aspiraciĂłn con aguja transbronquial (TBNA)
La
ecografĂa endobronquial (EBUS) es una tĂŠcnica
mĂnimamente invasiva que permite el muestreo de tejido de lesiones pulmonares
perifĂŠricas o maÂsas mediastĂnicas/hiliares, con una alta precisiĂłn diagnĂłstica y una
morbilidad y mortalidad signifiÂcativamente menor que los enfoques
alternativos. En pacientes pediĂĄtricos, la EBUS - aspiraciĂłn con aguja transbronquial (TBNA) se utiliza principalÂmente para
diagnosticar adenopatĂas mediastĂniÂcas. Esto ha
llevado a un mayor ĂŠxito diagnĂłstico, con una tasa reducida de complicaciones.
Debido a la escasa cooperaciĂłn de los niĂąos y las preocuÂpaciones de sus
padres, el muestreo de los ganÂglios linfĂĄticos es difĂcil. La EBUS es un
enfoque seguro y demuestra una excelente sensibilidad, especificidad y
precisiĂłn, y se ha convertido en una herramienta Ăştil para los pediatras.37
Un
estudio multicĂŠntrico analizĂł retrospecÂtivamente a
67 participantes pediĂĄtricos que se sometieron a aspiraciĂłn con aguja transbronÂquial guiada por ecografĂa endobronquial
(EBUS-TBNA) o aspiraciĂłn con aguja fina guiada por ultrasonido broncoscĂłpico transesofĂĄgico
(EUS-B-FNA). A excepciĂłn de dos pacientes en los que no se detectĂł un ganglio
linfĂĄtico significativo en la EBUS, se obtuvo una muestra adecuada en 60 (92,3
%) participantes y una muestra diagnĂłstica en 37 (56,9 %) participantes. La
sensibilidad de EBUS-TBNA / EUS-B-FNA fue del 79,1 % y el diagnĂłstico se
modificĂł en 28 (41,8 %) particiÂpantes. Los autores de ese estudio consideraron
que EBUS-TBNA y EUS-B-FNA son mĂŠtodos de diagnĂłstico seguros y efectivos para
la evaluaciĂłn de niĂąos con linfadenopatĂas
mediastĂnicas.38
Ventajas:
La
EBUS puede mostrar claramente la relaciĂłn entre los vasos sanguĂneos, los
ganglios linfĂĄticos y las lesiones que ocupan espacio en el mediastino extraganglionar.
Desventajas:
Aunque
EBUS tiene muchas ventajas, todavĂa existen algunos inconvenientes. La
estructura especĂfica de los bronquios en los niĂąos plantea algunos obstĂĄculos.
El tamaĂąo mĂĄs pequeĂąo de la trĂĄquea pediĂĄtrica y su posiciĂłn mĂĄs profunda
limitan el uso del mĂŠtodo. La incidencia de rotura del dispositivo es alta y el
costo de repaÂraciĂłn es alto. Su aplicaciĂłn estĂĄ contraindicada en pacientes
con funciĂłn pulmonar seriamente reduÂcida o insuficiencia respiratoria, funciĂłn
cardĂaca excesivamente deteriorada, hemoptisis masiva y condiciones generales
debilitantes. La precisiĂłn del diagnĂłstico depende de muchos factores, como el
tamaĂąo de la aguja, la experiencia del operador y el sitio de los ganglios
linfĂĄticos.39, 40
7. ExĂĄmenes microbiolĂłgicos / aplicabilidad clĂnica
Dra. Graciela Luque
Hay
varios desafĂos en la confirmaciĂłn del diagÂnĂłstico de la TBI que se derivan de
los resultaÂdos radiogrĂĄficos sutiles o no especĂficos y de la naturaleza paucibacilar de la enfermedad. Un diagnĂłstico confirmatorio
se basa en la detecciĂłn directa del patĂłgeno; los acercamientos alternatiÂvos
incluyen la detecciĂłn de la inmunorrespuesta o de
histologĂa compatible. Las pruebas directas basadas en patĂłgenos incluyen el
cultivo, las prueÂbas de amplificaciĂłn de ĂĄcidos nucleicos (NAAT) y la baciloscopia. Hasta la fecha, no existe una prueba
diagnĂłstica precisa para la TBI. Por lo tanto, es esencial que los mĂŠdicos
observen que la TB es a menudo un diagnĂłstico clĂnico, ya que una prueba
negativa no descarta la enfermedad en los niĂąos. Siempre deben estudiarse las muestras
con cultivo de los niĂąos sintomĂĄticos y los que preÂsenten manifestaciones en
lesiones pulmonares o extrapulmonares.21, 41, 42
SelecciĂłn,
recolecciĂłn y transporte de muestras
Es
imprescindible tener en cuenta tanto la capaÂcitaciĂłn del personal que toma las
muestras con protocolos estandarizados como las explicaciones al paciente o su
acompaĂąante. La capacidad del operador, la calidad de la muestra obtenida y el
transporte son requisitos que influyen para llegar al diagnĂłstico.
Las
muestras deben tomarse en condiciones de aislamiento respiratorio, con
protecciĂłn del operador, en envases estĂŠriles y transportarse al laboratorio en
cajas rĂgidas, impermeables, con cierre hermĂŠtico. Los remitos deben ser claros
y completos: datos de filiaciĂłn, tipo de muestra que se envĂa, condiciones,
diagnĂłstico y pruebas que se solicitan.43
Se
ha tratado de mejorar el rendimiento del diagÂnĂłstico microbiolĂłgico con una
amplia variedad de tipos de muestras e, incluso, combinar diferentes mĂŠtodos o
reunir muestras en un pool.44, 45
Recolectar
una muestra respiratoria profunda para el cultivo de un niĂąo pequeĂąo trae
desafĂos adicionales. La mayorĂa de los niĂąos menores de 7 aĂąos no tienen la
fuerza tusiva o la coordinaciĂłn oromotora
para producir una muestra de esputo expectorado de buena calidad, requieren
tĂŠcnicas semiinvasivas como la aspiraciĂłn/lavado
gĂĄstrico o el esputo inducido (con aspiraciĂłn nasofarĂngea o sin esta). Ambos
tienen un rendimiento microbioÂlĂłgico similar, con una sensibilidad entre el 30
% y el 50 %.46, 47
Un
mĂŠtodo alternativo para obtener muestras respiratorias incluye el uso de la
prueba de cuerda en la que se ingiere una cĂĄpsula de gelatina que contiene una
cuerda de nailon (cuerda dulce) y, luego, se recupera para el cultivo.48
Aunque promisorio tiene dificultades para la degluciĂłn en menores de cuatro
aĂąos y se ha investigado su uso en grupos pequeĂąos con resultados similares al
esputo inducido.49
El
lavado broncoalveolar (LBA) es un proceÂdimiento
invasivo que requiere entrenamiento especializado y no es bien tolerado en
niĂąos. Tiene indicaciĂłn en circunstancias especĂficas de sospeÂcha con otras
muestras negativas, en el diagnĂłstico diferencial o falta de respuesta al tratamiento.
El rendimiento estĂĄ supeditado al tipo de lesiĂłn que se estudie y el mĂŠtodo de
aislamiento clĂĄsico o molecular.50
La
aspiraciĂłn nasofarĂngea (ANF) y el hisopado oral son muestras alternativas aĂşn
potenciales. Se necesitan mĂĄs pruebas antes de que pueda ser reÂcomendado como
uno de los mĂŠtodos de recolecciĂłn de muestras en niĂąos.46
Las
muestras en materia fecal (stool test)
se utilizan con buffers y tienen baja sensibilidad en niĂąos (32 % a 68
%). Es usado en pacientes VIH positivos para tĂŠcnicas moleculares.51
En
la TB extrapulmonar, el rendimiento es vaÂriable, las
muestras deben ser representativas del sitio de la infecciĂłn, recolectadas
asĂŠpticamente y almacenadas y transportadas rĂĄpidamente al laboratorio para
minimizar la multiplicaciĂłn de los Ăłrganos contaminantes. Idealmente, las
muestras deben llegar al laboratorio el dĂa de la recolecciĂłn. Si el transporte
al laboratorio se retrasa mĂĄs de una hora, las muestras deben refrigerarse a 4
°C, asà como a su llegada al laboratorio hasta que se procesen.52
El
lĂquido cefalorraquĂdeo (LCR) debe proceÂsarse de inmediato o conservarlo
refrigerado por menos de 12 h. En el caso de la orina, se obtienen 2 muestras
en dĂas consecutivos o dĂa por medio y se remite el mayor volumen posible
(incluso, recolecciĂłn de varias micciones). La muestra debe ser procesada
inmediatamente porque el pH ĂĄcido afecta la viabilidad del bacilo. En otros
lĂquidos (pleural, ascĂtico, articular) el rendimiento no es mucho mayor que
las muestras respiratorias, pero mejora si se combina con biopsias u otros
mĂŠtodos no microbiolĂłgicos.53
En
la TB ganglionar perifĂŠrica o en abscesos, se obtiene material por aspiraciĂłn,
punciĂłn con aguja fina o biopsia. No deben usarse hisopos o torundas de
algodĂłn. En las muestras de tejidos o biopsias, debe evitarse la desecaciĂłn
agregando agua destilada estĂŠril.
En
las formas diseminadas y en los pacientes inmunocomprometidos, se deben
realizar tambiĂŠn hemocultivos.52
8. HistopatologĂa
Dra. Karina Melillo
El
diagnĂłstico histopatolĂłgico se realiza con mayor frecuencia en la TB
extrapulmonar.54 El rendimienÂto general no estĂĄ bien caracterizado
y depende en cierta medida de la experiencia del operador y el patĂłlogo; la
sensibilidad y la especificidad pueden verse obstaculizadas por otros procesos
granulomatosos.
La
biopsia y la autopsia permiten determinar la presencia de los bacilos ĂĄcido
alcohol resistentes (BAAR) a travĂŠs del estudio histopatolĂłgico y de estudios
especiales confirmatorios, tales como la tĂŠcnica de ZN.54
La
tinciĂłn de Kinyoun es similar a la de ZN, pero no
utiliza el calor para favorecer la captaciĂłn. Las tĂŠcnicas flurocrĂłmicas
con auramina-rodamina se basan en el mismo principio
bĂĄsico, pero permiten una mĂĄs rĂĄpida y mĂĄs cĂłmoda visualizaciĂłn de las micobacterias.
Al
examinar las secciones titulares teĂąidas con hematoxilina-eosina, (H-E), suelen
encontrarse agregados granulomatoides conformados por
abundantes histiocitos cargados por bacilos de aproximadamente 3 μm o granulomas de aspecto arremolinado con cĂŠlulas
gigantes multinucleadas tipo Langhans con nĂşcleos
dispuestos en la periÂferia en forma de ÂŤCÂť, con necrosis central, no siempre
acompaĂąadas por linfocitos reactivos (graÂnuloma necrosante).
La existencia de granulomas mĂşltiples en diferentes estadios evolutivos, con
necrosis caseificante central, sugiere el diagnĂłstico
de TB, si bien, mĂşltiples entidades pueden producir granulomas.54
Las lesiones exudativas (exudados fibrinosos con invasiĂłn alveolar de
neutrĂłfilos) son mĂĄs frecuentes en inmunocomprometidos y de peor pronĂłstico.
Pueden coexistir ambas, segĂşn la evoluciĂłn de la enfermedad.
La
hibridaciĂłn con sondas de ADN permite la rĂĄpida identificaciĂłn de la especie
aislada en culÂtivo e, incluso, a partir de bloques de parafina con tejido
incluido.
Conflicto de intereses
Las
autoras de este trabajo no declaran conflicto de interĂŠs alguno.
BIBLIOGRAFĂA
1. World Health Organization. Rapid communication on updated guidance on the management of
tuberculosis in children and adolescents. Geneva: World Health
Organization; 2021. https://www.who.int/publications/i/item/9789240033450
2. WHO consolidated guidelines on
tuberculosis. Module 5: management of tuberculosis in
children and adolescents. Geneva: World Health Organization; 2022. Licence: CC BY-NC-SA 3.0 IGO.
3.
BoletĂn N.° 5 Tuberculosis y lepra en la Argentina AĂąo V - CoordinaciĂłn de
tuberculosis y lepra. DirecciĂłn de respuesta al VIH, ITS, hepatitis virales y
tuberculosis, Ministerio de Salud, Argentina. Marzo de 2022.
4. WHO operational handbook on
tuberculosis. Module 2: screening - systematic screening for tuberculosis
disease. Geneva: World Health Organization; 2021. License: CC BY-NC-SA 3.0 IGO.
https://www.who.int/publications/i/item/9789240022676.
5.
GutiĂŠrrez D, VĂĄsquez A. La tuberculosis infantil: Enfoque epidemiolĂłgico y
nuevas alternativas de diagnĂłstico. Rev Cs Farm y Bioq (PerĂş) 2014;2:93-100. Disponible en:
http://www.scielo.org.bo/scielo.php?script=sci_arttext&pid=S2310-02652014000100011&lng=es.
ISSN 2310-0265
6.
Holcberg M, Zabala C, GutiĂŠrrez S, Sisto G, Sosa M, Giachetto G.
Prevalencia y caracterĂsticas de niĂąos con tuberculosis diagnosticados a partir
de un caso Ăndice. Uruguay 2012-2014. Arch Pediatr Urug 2016;87:S3-S10. Disponible en: http://www.scielo.edu.uy/scielo.php?script=sci_arttext&pid=S1688-12492016000500001&lng=es
7.
PĂŠrez-VĂŠlez CM, Marais BJ. Tuberculosis in children. N Engl J Med 2012;367:348-61.
https://doi.org/10.1056/NEJMra1008049.
8. MartĂnez
L, Cords O, Horsburgh CR, Andrews JR. Pediatric TB
Contact Studies Consortium. The risk of tuberculosis in children after close
exposure: a systematic review and individual-participant meta-analysis. Lancet 2020; 395:973- 84.
https://doi.org/10.1016/S0140-6736(20)30166-5.
9.
Roya-Pabon CL, PĂŠrez-VĂŠlez CM. Tuberculosis exposure, infection and disease in children: a systematic
diagnostic approach. Pneumonia 2016;8:23.
https://doi.org/10.1186/s41479-016-0023-9.
10. Marais BJ, Gie RP, Hesseling AC, et al. A refined symptom-based approach to diagnose
pulmonary tuberculosis in chilÂdren. Pediatrics.
2006;118: e1350-9.
https://doi.org/10.1542/peds.2006-0519.
11. Vonasek
B, Ness T, Takwoingi, et al. Screening
tests for active pulmonary tuberculosis in children. Cochrane Database Syst Rev 2021;6::CD013693.
https://doi.org/10.1002/14651858.CD013693.pub2.
12.
Cruz Anleu ID, VelĂĄsquez Serratos JR. Tuberculosis
infantil. ÂżCĂłmo diagnosticarla? [Childhood
tuberculosis. How to diagnose it?]. Arch Argent Pediatr.
2012;110:144-51. https://doi.org/10.5546/aap.2012.144.
13.
Ramos Amador JT, Berzosa SĂĄnchez A., Callejas
Caballero I.,IllĂĄn Ramos M..
Tuberculosis pulmonar
en PediatrĂa. Pediatr Integral 2021;15:76-90.
14. Marais BJ, Pai M. Recent advances in the diagnosis of childhood
tuberculosis. Arch Dis Child 2007;92:446-52. https://doi.org/10.1136/adc.2006.104976.
15. Migliori
GB, Ong C, Petrone L, D'Ambrosio L, Centis R, Gotelli D. The definition of tuberculosis infection based
on the spectrum of tuberculosis disease. Breathe 2021;17
210079.https://doi.org/10.1183/20734735.0079 2021.
16. Vieira JL, Foschiera L, Ferreira ICS, Chakr
VC. Performance of the quantification of adenosine deaminase and determination of the lactate
dehydrogenase/adenosÂine deaminase ratio for the
diagnosis of pleural tuberculosis in children and adolescents. J Bras Pneumol. 2021;47:e20200558. https://doi.org/10.36416/1806-3756/e20200558.
17. Zhang M, Li D, Hu ZD, Huang
YL. The diagnostic utility of pleural markers for
tuberculosis pleural effusion. Ann Transl Med 2020;8:607-18.
https://doi.org/10.21037/atm.2019.09.110.
18.
Sociedad Argentina de PediatrĂa. ComitĂŠ Nacional de NeumonologĂa.
Coordinadora: Dra. Norma GonzĂĄlez. Criterios de diagnĂłstico y tratamiento de la
tuberculosis infantil. Consenso. Arch Argent Pediatr
2016;114:189. https://doi.org/10.5546/aap.2016.189.
19. Cobat
A, Poirier C, Hoal E, et al. Tuberculin Skin Test
Negativity Is Under Tight Genetic Control of Chromosomal Region 11p14-15 in
Settings With Different Tuberculosis Endemicities. J
Infect Dis 2015;211:317-21.
https://doi.org/10.1093/infdis/jiu446
20. Lewinsohn
DM, Leonard MK, Lo Bue PA, et al. Official American
Thoracic Society/Infectious Diseases Society of America/Centers for Disease
Control and Prevention CliniÂcal Practice Guidelines: Diagnosis of Tuberculosis
in Adults and Children. Clin Infect Dis. 2017;64:e1-e33. https://doi.org/10.1093/cid/ciw694.
21. Chiappini
E, Storelli F, Tersigni C, Venturini E, Martino M, Galli L. QuantiFERON-TB Gold In-Tube test performance in a large
pediatric population investigated for suspected tuberculosis infection. Paediatr Respir Rev 201932:36-47.
https://doi.org/10.1016/j.prrv.2019.03.010.
22. Ruhwald
M, Aggerbeck H, Gallardo RV, et al. Safety and
efficacy of the C-Tb skin test to diagnose Mycobacterium tuberculosis infection,
compared with an interferon γ release assay and
the tuberculin skin test: a phase 3, double-blind, randomized, controlled
trial. Lancet Respir Med 2017;5:259-68.
https://doi.org/10.1016/S2213-2600(16)30436-2.
23. Slogotskaya
L, Bogorodskaya E, Ivanova
D, Sevostyanova T. Comparative sensitivity of the
test with tuberculosis recombinant allergen, containing ESAT6-CFP10 protein,
and Mantoux test with 2 TU PPD-L in newly diagnosed
tuberculosis children and adolescents in Moscow. PLoS ONE 2018. 13: e0208705.
https://doi.org/10.1371/journal.pone.0208705
24. Starshinova
A, Dovgalyk I, Malkova A et al. Recombinant tuberculosis allergen (DiaskintestÂŽ) in tuberculosis diagÂnostic in Russia (MetaAnalysis). Int J Mycobacteriol 2020; 9:335-46. https://doi.org/10.4103/ijmy.ijmy_131_20.
25. Zellweger
JP, Heinzer R, Touray M, Vidondo B, Altpeter E.
Intra-observer and overall agreement in the radioÂlogical assessment of
tuberculosis. Int J Tuberc
Lung Dis. 2006;10:1123-6.
26. ConcepciĂłn ND, Laya BF, Andronikou S, et al.
Standardized radiographic interpretation of thoracic tuberculosis in children. Pediatr Radiol. 2017;47:1237-48. https://doi.org/10.1007/s00247-017-3868-z.
27. Jain SK, Andronikou
S, Goussard P, et al. Advanced imagÂing tools for
childhood tuberculosis: potential applications and research needs. Lancet Infect
Dis. 2020;20: e289-e297.
https://doi.org/10.1016/S1473-3099(20)30177-8.
28.
Buonsenso D, Pata D, Visconti E, et al. Chest CT Scan for the Diagnosis of Pediatric Pulmonary
TB: Radiological Findings and Its Diagnostic Significance. Front. Pediatr. 2021; 9:583197.
https://doi.org/10.3389/fped.2021.583197.
29.
De La Quintana Gordon FB, Nacarino Alcorta B. EcografĂa pulmonar bĂĄsica. Parte
1. EcografĂa pulmonar normal y patologĂa de la pared torĂĄcica y la pleura. Rev Esp Anestesiol
Reanim 2015;62: 322-36.
https://doi.org/10.1016/j.redar.2015.02.003
30.
Vollmer I, Gayete A.
EcografĂa torĂĄcica. Arch Bronconeumol. 2010;46:27-34.
https://doi.org/10.1016/j.arbres.2008.12.004.
31.
Oyonarte WM. Enfoque diagnĂłstico en el paciente con
derrame pleural. Rev Med Clin Condes - 2015;26:313-24.
https://doi.org/10.1016/j.rmclc.2015.06.008
32.
RamĂrez-Lapausa M., MenĂŠndez-SaldaĂąa A., Noguerado-
Asensio A. Tuberculosis extrapulmonar, una revisiĂłn. Rev Esp Sanid
Penit 2015;17:3-11.
https://doi.org/10.4321/S1575-06202015000100002.
33.
Bilbao Sustacha JA, Peix Sambola MA, Alonso MartĂn DE, DĂaz LĂĄzaro J. AplicaciĂłn de
la ecografĂa clĂnica pediĂĄtrica en AtenciĂłn Primaria. En: AEPap
(ed.). Congreso de ActualizaciĂłn PediatrĂa 2019. Madrid: LĂşa Ediciones 3.0;
2019. p. 495-506.
34.
Tovar DĂaz M, Tang VelĂĄsquez AM, Concha Mendoza ND.
Tuberculosis extrapulmonar en pediatrĂa: un reto diagÂnĂłstico.
Rev. Medicas UIS 2013;26:45-58. Disponible en: https://revistas.uis.edu.co/index.php/revistamedicasuis/article/view/3582.
35.
Guarda ME, Kreft J. Tuberculosis en el niĂąo ÂżCĂłmo se
diagnostica? Rev Med Clin Condes - 2017;28:104-10.
https://doi.org/10.1016/j.rmclc.2017.02.011.
36. Ruby LC, Heuvelings
CC, Grobusch MP, Andronikou
S, BĂŠlard S. Transthoracic mediastinal
ultrasound in childhood tuberculosis: A review. Paediatr
Respir Rev. 2022;41:40-8.
https://doi.org/10.1016/j.prrv.2020.11.002.
37. Steinfort
DP, Wurzel D, Irving LB, Ranganathan
SC. Endobronchial ultrasound in pediatric
pulmonology. Pediatr Pulmonol.
2009;44:303-8. https://doi.org/10.1002/ppul.20991.
38. Dhooria
S, Madan K, Pattabhiraman
V, et al. A multicenter study on the utility and safety of
EBUS-TBNA and EUS-B-FNA in children. Pediatr Pulmonol. 2016;51:1031-9.
https://doi.org/10.1002/ppul.23415.
39. Park M, Owles
H, Williams A, Williams B, Whittaker E, Kon OM.
Pediatric Endobronchial Ultrasound-Transbronchial Needle Aspiration Under Conscious Sedation
for Suspected Tuberculosis in London. Pediatr Infect
Dis J. 2020;39:e329- 31.
https://doi.org/10.1097/INF.0000000000002819
40. Gulla
KM, Gunathilaka G, Jat KR
et al. Utility and safety of endobronchial
ultrasound-guided transbronchial needle aspiration
and endoscopic ultrasound with an echobronchoscope-guided
fine needle aspiration in children with mediastinal
pathology. Pediatr Pulmonol.
2019;54:881-5. https://doi.org/10.1002/ppul.24313.
41. Cuevas LE, Petrucci R, Swaminathan S.
Tuberculosis diagnostics for children in high-burden countries: what is
available and what is needed. Paediatr Int Child Health. 2012;32(Suppl 2):S30-7.
https://doi.org/10.1179/2046904712Z.00000000076.
42.
Ministerio de Salud. Gobierno de El Salvador. GuĂa clĂnica para la atenciĂłn
pediĂĄtrica de la tuberculosis y la coinfecÂciĂłn
TB-VIH. San Salvador, El Salvador 2021.
http://asp.salud.gob.sv/regulacion/default.asp
43. Starke J, Cruz AI. Diagnosing Childhood Tuberculosis: A Small Step Forward.
JAMA Pediatrics 2021;175: e206078.
https://doi.org/10.1001/jamapediatrics.2020.6078
44. Datta
S, Shah L, Gilman RH, Evans CA. Comparison of sputum collection methods for
tuberculosis diagnosis: a systematic review and pairwise and network
meta-analysis. Lancet Glob Health 2017;5:e760â71.
https://doi.org/10.1016/S2214-109X(17)30201-2.
45. Ioos
V, Cordel H, Bonnet M. Alternative sputum collection
methods for diagnosis of childhood intrathoracic
tuberculosis: a systematic literature review. Arch Dis Child 2019;104:629-35.
https://doi.org/10.1136/archdischild-2018-315453.
46. Ruiz JimĂŠnez M, GuillĂŠn MartĂn S, Prieto Tato LM, et al. Induced sputum versus gastric lavage for
the diagnosis of pulmonary tuberculosis in children. BMC Infect Dis. 2013;
13:222-8. https://doi.org/10.1186/1471-2334-13-222.
47. Tafur
KT, Coit J, Leon SR, et al. Feasibility of the string
test for tuberculosis diagnosis in children between 4 and 14 years old. BMC
Infect Dis. 2018;18:574-81.
https://doi.org/10.1186/s12879-018-3483-0.
48. Imperiale
BR, Nieves C, Mancino B, et al. String test: A new
tool for tuberculosis diagnosis and drug-resistance detection in children. Int J Mycobacteriol. 2018;7:162-6. https://doi.org/10.4103/ijmy.ijmy_54_18.
49. Goussard
P, Retief F, Burke J, Malherbe A, Janson J. The role of bronchoscopy in the diagnosis and management of pediatric
pulmonary tuberculosis. Ther Adv Infectious Dis 2021;8:1-19.
https://doi.org/10.1177/20499361211037168
50. Mesman
AW, RodrĂguez C, Ager E, Coit J, Trevisi
L, Franke MF. Diagnostic accuracy of molecular
detection of Mycobacterium tuberculosis in pediatric stool samples: A
systematic review and meta-analysis. Tuberculosis (Edinb). 2019;119:101878.
https://doi.org/10.1016/j.tube.2019.101878
51. Dunn JJ, Starke JR, Revell PA. Laboratory diagnosis of MyÂcobacterium
tuberculosis infection and disease in children. J Clin
Microbiol 2016; 54:1434-41.
https://doi.org/10.1128/JCM.03043-15.10.1016/j.jctube.2020.100164
52.
Foppiano Palacios C, Saleeb
PG. Challenges in the diÂagnosis
of tuberculous meningitis. J Clin Tuberc Other
Mycobact Dis 2020;20:100164.
https://doi.org/10.1016/j.jctube.2020.100164.
53. Bagdia
M, Bijwe S, Hirani N, Joshi
A, Chowdhary A, Agrawal M, Bagdia A. Lab Diagnosis of Extra Pulmonary Tuberculosis:
Comparison of Histopathology, Cytology, ZeihlNeelsen
stain and Light Emission Diode Microscopy with Culture and Nucleic Acid
Amplification Tests. Int J Cur Res Rev 2018; 10:15-9.
https://doi.org/10.7324/IJCRR.2018.10803.
54. Shah KK, Pritt BS, Alexander MP. Histopathologic review of granulomatous inflammation. J Clin
Tuberculosis Other Mycobacterial Dis 2017; 7:1-12.
https://doi.org/10.1016/j.jctube.2017.02.001