Autor : Arrojo, Marisol1, González, Alejandra1, Zurita, Ingrid1, Fielli, Mariano1, Carreño, Ruth1
1Servicio NeumologĂa. Hospital Nacional Prof. Dr. Alejandro Posadas. El Palomar. Provincia de Buenos Aires. Argentina.
https://doi.org/10.56538/ramr.WIKB9335
Correspondencia : Marisol Arrojo marisolarrojo@hotmail.com
RESUMEN
Se
presenta el caso de un paciente con diagnóstico de adenocarcinoma de
pulmón metastásico que, luego de
realizar cinco meses de tratamiento con pembrolizumab,
presentó neumonitis grado 2, interpretada como toxicidad por pembrolizumab con buena respuesta y resolución de
los infiltrados con la suspensión del inmunomodulador
y la administración de corticoides.
Palabras
clave: Pembrolizumab; toxicidad pulmonar; PD-L1 positivo;
cáncer de pulmón de células no pequeñas (CPNCP)
ABSTRACT
We present the case of a patient diagnosed with metastatic lung adenocarcinoma who, after five
months of treatment with pembrolizumab, presented grade 2 pneumonitis, interÂpreted as pembrolizumab toxicity, with a good response and resolution of the infiltrates with the suspension
of the immunomodulator and the administration of corticosteroids.
Key
words: Pembrolizumab; Pulmonary
Toxicity; PD-L1 Positive; non-small
cell lung cancer (NSCLC)
Recibido: 08/11/2022
Aceptado: 23/03/2023
INTRODUCCIÓN
El
pembrolizumab es un anticuerpo monoclonal designado
como terapia para el tratamiento de pacientes con cáncer de
pulmón de células no pequeñas (CPNCP) metastásico,
cuyos tumores expresan la proteína de superficie PD-1 (programÂmeddeath-ligand 1)1, 2 (Figura 1).

El
pembrolizumab prolonga la sobrevida y tiene un perfil
riesgo-beneficio favorable en pacientes con CPNCP avanzado, PD-L1 positivo. Es
conÂsiderado una nueva opción de tratamiento.3
Los inmunomoduladores han revolucionado
la terapia contra el cáncer, pero se debe tener en cuenta que el
reconocimiento y tratamiento tempranos de los efectos adversos es
crítico. Si bien presentan un perfil de toxicidad relativamente leve,
los eventos adversos inmunomediados pueden
manifestarse y ser graves.
CASO CLÍNICO
Se
trata de un hombre de 65 años de edad, extabaquista,
con hipertensión arterial, enfermedad pulmonar obstructiva crónica
(EPOC) (con un volumen espiratorio forzado en el primer segundo [VEF1] del
78%), insuficiencia cardíaca, dislipemia e
hipertrofia prostática benigna. Se encontraba en seguimiento por el
servicio de oncología debido a un adenocarcinoma de pulmón del
lóbulo superior derecho. La biopsia quirúrgica evidenció
el siguiente patrón de muÂtaciones: CK7 positivo, EGFR no mutado, ALK
negativo, PD-L1 positivo, TPS 60%, con tomografía de tórax en la
que se observó opacidad pulmonar en el lóbulo superior derecho,
de bordes espiculados, heterogéneos, en
contacto pleural con los nódulos en el lóbulo medio y el
lóbulo inferior izquierdo (Figura 2).

Luego
de cinco meses de tratamiento con pembrolizuÂmab,
presentó disnea y tos con caída de la saturación de
oxígeno, por lo que es derivado a neumonología.
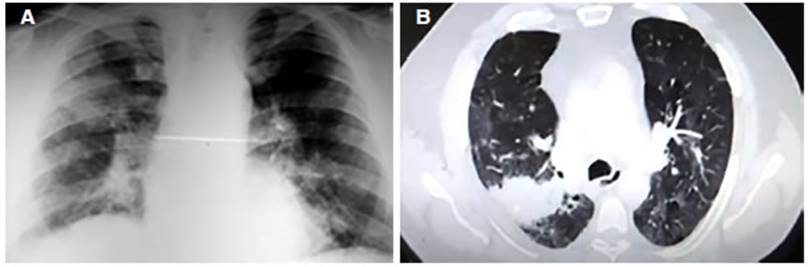
Se realizó una radiografía de tórax que evidenció
infiltrados heterogéÂneos bilaterales (Figura 3 A). En la
tomografía de tórax, se observaba una imagen de bordes espiculados y cavitada en
lóbulo superior derecho que se extendía al lóbulo
inferior, de 76 mm Ă— 45 mm y nódulos en el lóbulo medio y
lóbulo inferior izquierdo con infiltrados intersticiales agregados.
Adenomegalias hiliares derechas y mediastinales.
Se desÂestimó sobreinfección (Figura 3 B).

Se
presentó el caso en un ateneo multidisciplinario y se acordó
suspender el tratamiento con pembrolizumab haÂbiendo
interpretado la disnea y los nuevos infiltrados como secundarios a toxicidad.
Además, se inició la administración de meprednisona
40 mg/d, que produjo una franca mejoría a los 15 d. Se interpretó
el cuadro como neumonía organizada criptogénica
secundaria a pembrolizumab. Luego de 5 meses de tratamiento
con corticoides el paciente no presentaba síntomas respiratorios y
demostraba una mejoría significaÂtiva de los infiltrados
radiológicos (Figura 4 A y B). Se dio por concluido el tratamiento con
esteroides.
DISCUSIÓN
El
PD-1 L está presente en las células tumorales y tiene un efecto
protector en estas. El pembroliÂzumab es un
anticuerpo monoclonal humanizado anti-PD-1 altamente selectivo diseñado
para bloÂquear la interacción entre PD-1 y sus ligandos,
lo que potencia la actividad celular antitumoral1.
Los
estudios preclínicos han encontrado que la radioterapia mejora las
respuestas inmunitarias antitumorales también. En una evaluación
de 98 pacientes, en donde se comparó la combinación de
tratamiento de pembrolizumab con radioterapia y sin
esta, la supervivencia libre de progresión en el grupo con pembrolizumab y radioterapia fue signiÂficativamente mayor
que en los pacientes sin radioÂterapia previa.4
Por orden de frecuencia, los efectos adversos en un grupo de
más de 500 pacientes que recibieron pembrolizumab
fueron fatiga, disminuÂción del apetito, disnea y tos. Los eventos
adversos inmunológicos más frecuentes fueron trastornos tiroideos
(hipotiroidismo e hipertiroidismo). Los más graves fueron derrame
pleural, neumonía, disnea, embolia pulmonar y neumonitis (3,5% de los
pacientes).5 Este
último evento se vio más frecuentemente en aquellos pacientes con
historia de EPOC, asma o que habían recibido radioterapia localizada en
el tórax. En un trabajo, se describen 915 pacientes que recibieron
anti-PD-1; 43 desaÂrrollaron neumonitis, de los cuales, uno falleció
durante el tratamiento inmunosupresor. El inicio de los síntomas fue muy
variable (desde días hasta más de un año). Los pacientes
presentaron disnea y tos como síntomas más frecuentes y, en menor
proporción, fiebre y dolor de pecho. Incluso algunos no presentaron
síntomas al inicio de la neumonitis y más del 50% presentaron
otras manifestaciones inmunomediadas, como hipofisitis, tiroiditis o artritis. El diagnóstico
de neumonitis se sospecha a partir de la presencia de infiltrados pulmonares
nuevos progresivos. La tomografía computarizada es la modalidad de
imagen elegida. Los hallazgos tomográficos
más frecuentes fueron neumonía organizada criptogénica6 e infiltrados
en “vidrio esmerilado”.7,
8 El
manejo de la neumonitis depende de su grado clínico y radiológico7.
Por
otro lado, Fujita y cols. publicó un caso de
enfermedad pulmonar intersticial difusa luego de la cirugía
torácica, en un paciente que había recibido previamente pembrolizumab como neoadÂyuvancia.
Creemos que el caso expuesto reafirma la importancia de realizar un monitoreo
frecuente de los posibles efectos adversos relacionados con el tratamiento del
CPNCP con inmunomoduladores por su potencial gravedad
y por la buena respuesta que presenta la toxicidad pulmonar por pembroliÂzumab a los corticoides sistémicos.9
Conficto de intereses
Los
autores no declaran ningún conflicto de interés
BIBLIOGRAFÍA
1.
Garon EB, Rizvi NA, Hui R, Leighl N, et al. Pembrolizumab for the Treatment
of Non–Small-Cell Lung Cancer. N Engl J Med. 2015;372:2018-28.
https://doi.org/10.1056/NEJMoa1501824
2.
Sul J, Blumenthal GM, Jiang
X, He K, Keegan P, Pazdur
R. FDA Approval Summary: Pembrolizumab for the TreatÂment of Patients With Metastatic
Non-Small Cell Lung Cancer Whose Tumors
Express Programmed Death-Ligand
1. Oncologist. 2016;21:643-50.
https://doi.org/10.1634/theoncologist.2015-0498
3.
Leroy V, Templier C, Faivre JB, Scherpereel A, Fournier C, Mortier L, Wemeau-Stervinou L. Pembrolizumab-induced
pneumonitis. ERJ Open Res. 2017;3:00081-2016.
https://doi.org/10.1183/23120541.00081-2016
4.
Shaverdian N, Lisberg AE, Bornazyan K, Veruttipong D,
Goldman JW, Formenti SC, et al. Previous
radiotherapy and the clinical activity and toxicity of pembrolizumab in the treatment of non-small-cell lung
cancer: a secondÂary analysis of the KEYNOTE-001 phase 1 trial. Lancet Oncol. 2017;18:895-903.
https://doi.org/10.1016/S1470-2045(17)30380-7
5.
Leighl NB, Hellmann MD, Hui
R, et al. Pembrolizumab in patients
with advanced non-small-cell lung
cancer (KEYNOTE-001): 3-year results
from an open-label, phase 1 study. Lancet Respir
Med. 2019;7:347-57.
https://doi.org/10.1016/S2213-2600(18)30500-9
6.
Fragkou P, Souli M, Theochari M, Kontopoulou C, Loukides S, Koumarianou A. A Case
of Organizing Pneumonia
(OP) Associated with Pembrolizumab. Drug Target Insights. 2016;10:9-12.
https://doi.org/10.33393/dti.2016.1420
7.
Naidoo J, Wang X, Woo KM,
et al. Pneumonitis in Patients
Treated With Anti-Programmed Death-1/Programmed Death Ligand 1 Therapy. J Clin Oncol. 2017;35:709-17.
https://doi.org/10.1200/JCO.2016.68.2005
8.
Herbst RS, Baas P, Kim DW,
et al. Pembrolizumab versus docetaxel
for previously treated, PD-L1-positive, advanced
non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet. 2016;387:1540-50.
https://doi.org/10.1016/S0140-6736(15)01281-7
9.
Fujita T, Hayama N, Kuroki T, et al. Pembrolizumab-induced
interstitial lung disease following thoracic surgery in a patient with non-small cell lung
cancer. Thorac Cancer. 2019;10:2179-82.
https://doi.org/10.1111/1759-7714.13194